
 6SO2+Fe3O4,有3 molFeS2参加反应,转移 mol电子
6SO2+Fe3O4,有3 molFeS2参加反应,转移 mol电子 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案科目:高中化学 来源:不详 题型:单选题
| A.先滴加氯水,再滴加KSCN溶液后显红 |
| B.只需滴加KSCN溶液 |
| C.先滴加KSCN溶液,不显红色,再滴加氯水后显红色 |
| D.加Na2O2固体后观察沉淀颜色的变化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.48 mol | B.0.42mol | C.0.32 mol | D.0.28 mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.15.12 L | B.10.08 L | C.2.24 L | D.3.36 L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1:1 | B.1:2 | C.2:1 | D.2:3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
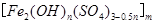 ,广泛用于污水处理。实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4·7H2O )过程如下:
,广泛用于污水处理。实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4·7H2O )过程如下: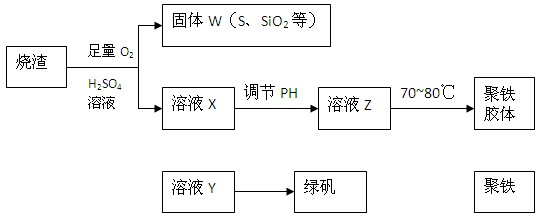
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com