
【题目】(1)下列物质:①.Cu ②.NaCl晶体 ③.NaHSO4 ④.CO2 ⑤.CaO ⑥HCl ⑦.稀H2SO4 ⑧. 熔融Ba(OH)2 ⑨.C2H5OH ⑩.NaCl溶液。
属于电解质的是(填序号,下同)_____,属于非电解质的是_____,能导电的是______。
(2)写出下列物质在水溶液中的电离方程式:
①NaHSO4 ___________________________;
②Al2(SO4)3 ________________________________;
③NH4NO3 ________________________。
(3)按要求写出下列方程式:
①写出硫酸铜溶液中滴加氢氧化钠溶液的反应的离子方程式:_____________。
②写出能用离子方程式CO32-+2H+=CO2↑+H2O表示的一个化学方程式:__________。
【答案】②③⑤⑥⑧ ④⑨ ①⑦⑧⑩ NaHSO4=Na++H++SO42- Al2(SO4)3=2Al3++3SO42- NH4NO3=NH4++NO3- Cu2++2OH-==Cu(OH)2↓ Na2CO3+2HCl=2NaCl+CO2↑+H2O(或其他)
【解析】
(1)在水溶液里或熔化状态下能够自身电离出离子的化合物是电解质,属于电解质的是NaCl晶体、NaHSO4、CaO、HCl、熔融Ba(OH)2,答案选②③⑤⑥⑧;在水溶液里和熔融状态下都不能自身电离出离子的化合物是非电解质,属于非电解质的是CO2、C2H5OH,答案选④⑨;含有自由移动电子或离子的物质可以导电,能导电的是Cu、稀H2SO4、熔融Ba(OH)2、NaCl溶液,答案选①⑦⑧⑩;(2)①NaHSO4在水溶液中的电离方程式为NaHSO4=Na++H++SO42-;②Al2(SO4)3在水溶液中的电离方程式为Al2(SO4)3=2Al3++3SO42-;③NH4NO3在水溶液中的电离方程式为NH4NO3=NH4++NO3-。(3)①硫酸铜溶液中滴加氢氧化钠溶液生成氢氧化铜沉淀和硫酸钠,反应的离子方程式为Cu2++2OH-==Cu(OH)2↓:②能用离子方程式CO32-+2H+=CO2↑+H2O表示的一个化学方程式可以是Na2CO3+2HCl=2NaCl+CO2↑+H2O。
点睛:化合物在水溶液中或受热熔化时本身能否发生电离是区别电解质与非电解质的理论依据,能否导电则是实验依据。因此能导电的物质不一定是电解质,如石墨;电解质本身不一定能导电,如NaCl晶体。
【题型】填空题
【结束】
27
【题目】为探究铁和铁的化合物的一些化学性质,某学生实验小组设计了以下实验。
(1)往A、B溶液中分别滴入几滴KSCN溶液,溶液的颜色A________,B____________。
(2)写出上述过程中有关反应的化学方程式:
Fe2O3→A_______________________;A→B____________________________。
(3)B→C可看到的现象是___________________________________________。
(4)将A的饱和溶液滴入沸水中并不断加热,可制得_______________胶体;当光束通过该胶体时,可看到一条光亮的“通路”,这种现象称为___________效应。
【答案】血红色 不变(浅绿色) Fe2O3+6HCl=2FeCl3+3H2O Fe+2FeCl3=3FeCl2 白色沉淀转变为灰绿色又转变为红褐色 Fe(OH)3 丁达尔
【解析】
(1)氧化铁与盐酸反应生成氯化铁,氯化铁与铁反应生成氯化亚铁,因此往A、B溶液中分别滴入几滴KSCN溶液,溶液A中显血红色,B中不变色;(2)Fe2O3与盐酸反应的方程式为Fe2O3+6HCl=2FeCl3+3H2O,A→B的方程式为Fe+2FeCl3=3FeCl2。(3)氯化亚铁与氢氧化钠反应生成氢氧化亚铁,氢氧化亚铁不稳定,易被氧化,所以B→C可看到的现象是白色沉淀转变为灰绿色又转变为红褐色。(4)将氯化铁饱和溶液滴入沸水中并不断加热,可制得氢氧化铁胶体;当光束通过该胶体时,可看到一条光亮的“通路”,这种现象称为丁达尔效应。


 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案科目:高中化学 来源: 题型:
【题目】过氧乙酸(CH3COOOH)不仅在卫生医疗、食品消毒及漂白剂领域有广泛应用,也应用于环境工程、精细化工等领域。实验室利用醋酸(CH3COOH)与双氧水(H2O2)共热, 在固体酸的催化下制备过氧乙酸(CH3COOOH),其装置如下图所示。请回答下列问题:
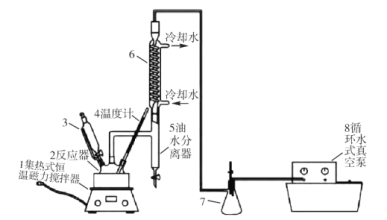
实验步骤:
I.先在反应瓶中加入冰醋酸、乙酸丁酯和固体酸催化剂,开通仪器1和8,温度维持为55℃;
II.待真空度达到反应要求时,打开仪器3的活塞,逐滴滴入浓度为35%的双氧水,再通入冷却水;
Ⅲ.从仪器 5定期放出乙酸丁酯和水的混合物,待反应结束后分离反应器2中的混合物,得到粗产品。
(1)仪器 6的名称是______,反应器 2中制备过氧乙酸(CH3COOOH)的化学反应方程式为_____。
(2)反应中维持冰醋酸过量,目的是提高_____;分离反应器 2中的混合物得到粗产品,分离的方法是_________。
(3)实验中加入乙酸丁酯的主要作用是_________(选填字母序号)。
A 作为反应溶剂,提高反应速率
B 与固体酸一同作为催化剂使用,提高反应速率
C 与水形成沸点更低的混合物,利于水的蒸发,提高产率
D 增大油水分离器 5的液体量,便于实验观察
(4)从仪器 5定期放出乙酸丁酯和水的混合物,待观察到___________(填现象)时,反应结束。
(5)粗产品中过氧乙酸(CH3COOOH)含量的测定:取一定体积的样品 VmL,分成 6等份,用过量 KI溶液与过氧化物作用,以 0.1mol L-1的硫代硫酸钠溶液滴定碘(I2+2S2O32-=2I-+S4O62-);重复 3次,平均消耗量为 V1mL。再以 0.02mol L-1的酸 性高锰酸钾溶液滴定样品,重复 3次,平均消耗量为 V2mL。则样品中的过氧乙酸的浓度为 ______mol L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3+N2+3C![]() 2AlN+3CO合成。下列叙述正确的是( )
2AlN+3CO合成。下列叙述正确的是( )
A. 上述反应中,N2是还原剂,Al2O3是氧化剂
B. 上述反应中,每生成1molAlN需转移3mol电子
C. AlN中氮元素的化合价为+3
D. CO是还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用质量分数为36.5%的浓盐酸(密度为1.16g/cm3)配制成1mol/L的稀盐酸。现实验室仅需要这种盐酸220mL。试回答下列问题:
(1)配制稀盐酸时,应选用的容量瓶规格是_____________(填序号)。
A.25mLB.50mLC.100mLD.250mL
(2)经计算需要______mL浓盐酸,在量取时宜选用下列量筒中的_____________(填序号)。
A.5mLB.10mLC.25mLD.50mL
(3)在量取浓盐酸后,进行了下列操作:
①等稀释的盐酸其温度与室温一致后,沿玻璃棒注入容量瓶中。
②往容量瓶中小心加蒸馏水至液面接近环形标线2~3cm处,改用胶头滴管加蒸馏水,使溶液的凹面底部与瓶颈的环形标线相切。
③在盛盐酸的烧杯中注入蒸馏水,并用玻璃棒搅动,使其混合均匀。
④用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶。
上述操作中,正确的顺序是_____________
A.①②③④B.③④①②C.④①②③D.③①④②
(4)在上述配制过程中,用刚刚洗涤洁净的量筒来量取浓盐酸,其配制的稀盐酸浓度是_____________(填“偏高”、“偏低”、“无影响”)。若未用蒸馏水洗涤烧杯内壁或未将洗涤液注入容量瓶,则配制的稀盐酸浓度是_____________(填“偏高”、“偏低”、“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾是中学常用的试剂。工业上用软锰矿制备高锰酸钾流程。

(1)上述流程中可以循环使用的物质有________、________(写化学式)。
(2)KMnO4稀溶液是一种常用的消毒剂。其消毒原理与下列物质相同的是________(填代号)。
a.84消毒液(NaClO溶液) b.75%酒精c.苯酚
(3)理论上(若不考虑物质循环与制备过程中的损失)1molMnO2可制得________molKMnO4。
(4)操作Ⅰ的名称是________;操作Ⅱ根据KMnO4和K2CO3两物质在________(填性质)上的差异,采用________(填操作步骤)、趁热过滤得到KMnO4粗晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中用足量的二氧化锰和含有4 mol氯化氢的浓盐酸充分反应制氯气,下列说法正确的是( )
A.该实验中共消耗1 mol 二氧化锰,生成1 mol氯气
B.为了除去氯气中混有的杂质气体,可以依次通过饱和食盐水和碱石灰
C.在该反应中二氧化锰作氧化剂,浓盐酸作还原剂
D.氯气可以用向上排空气法或排水法收集
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近发现,只含镁、镍和碳三种元素的晶体竟然也具有超导性。鉴于这三种元素都是常见元素,从而引起广泛关注。
(1)该新型超导晶体的一个晶胞如图所示,则该晶体的化学式是__________。镍在元素周期表中的位置是______,Ni2+的价电子有_________种不同运动状态。
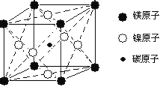
(2)500-600℃时,BeCl2以双聚分子存在的BeCl2的结构式为________________________。
(3)橙红色晶体羰基钴的熔点为52℃,分子式为Co2(CO)8,是一种重要的无机金属配合物,可溶于多数有机溶剂。该晶体属于______晶体,配体是______该配合物中存在的作用力类型有___________(填标号)。
A.金属键 B.离子键 C.共价键 D.配位键 E.氢键 F.范德华力
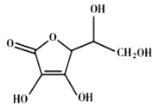
(4)抗坏血酸的分子结构如图所示,分子中碳原子的轨道杂化类型为_______;推测抗坏血酸在水中的溶解性:________(填“难溶于水”或“易溶于水”)。
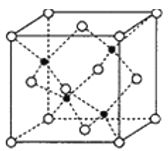
(5)副族元素Zn和元素Se形成的某化合物属于立方晶系,其晶胞结构如图所示,其中为( ![]() 为Se,
为Se,![]() 为Zn),Zn的配位数为______,该晶体的密度为
为Zn),Zn的配位数为______,该晶体的密度为![]() g/cm3,则Zn—Se键的键长为______nm。
g/cm3,则Zn—Se键的键长为______nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关同分异构体数目的叙述中,正确的是
A.不考虑空间异构,C2H6O的一氯代物有3种结构
B.分子式符合C5H11Cl的化合物有6种
C.已知二氯苯有3种同分异构体,则四氯苯的同分异构体的数目多于3种
D.菲的结构简式为![]() ,它与硝酸反应可生成6种一硝基取代物
,它与硝酸反应可生成6种一硝基取代物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】茉莉醛被广泛应用于食品、化妆品和洗涤剂中。实验室制备茉莉醛的反应:![]() +CH3(CH2)5CHO
+CH3(CH2)5CHO![]()
![]() +H2O,有关数据如下表:
+H2O,有关数据如下表:
相对分子质量 | 密度/g·cm-3 | 沸点/℃ | |
苯甲醛 | 106 | 1.04 | 179 |
庚醛 | 114 | 0.85 | 153 |
茉莉醛 | 202 | 0.97 | 287 |
实验室制备茉莉醛的装置示意图如下:

实验步骤:
在a中加入5.30 mL苯甲醛、5 mL95%乙醇、12 mL10%KOH溶液,在c中加入6.84 g庚醛。搅拌并加热至60~65℃,打开c向a中缓慢滴加庚醛。保温搅拌反应3 h。反应待冷却后,静置分层,分出有机层,水层用20 mL二氯甲烷分两次萃取,萃取分液后与有机层合并,有机层再用10 mL水洗涤3次,洗涤后加入无水Na2SO4。蒸馏,收集287~290℃馏分,馏分用柱色谱法进行分离,得纯净的茉莉醛4.04g。已知:柱色谱分离中,先将液体样品从柱顶加入,流经吸附柱时,即被吸附在柱的上端,然后从柱顶加入洗脱剂,由于吸附剂对各组分吸附能力不同,各组分以不同速度沿柱下移,从而达到分离的效果。
回答下列问题:
(1)仪器a的名称是___________,实验中应采取的加热方法是___________。
(2)在洗涤操作中,用水洗涤的主要目的是________,加入无水Na2SO4的目的是________。
(3)用二氯甲烷萃取分液时,水层在_____(填“上”或“下”)层。
(4)柱色谱法分离中使用的吸附剂为硅胶或碳酸钙,除此之外,还可以使用_______(填序号)
①活性炭 ②氯化钠 ③氧化铝 ④碳酸钾
(5)柱色谱法分离过程中,如果洗脱剂加入速度太快,会使产品产率_______(填“偏高”、“不变”、“偏低”)
(6)本实验所得茉莉醛产率为______%。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com