
 某研究小组用如图所示装置进行铜与浓硫酸反应的实验研究.
某研究小组用如图所示装置进行铜与浓硫酸反应的实验研究.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
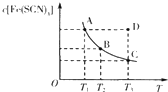 已知:FeCl3(aq)+3KSCN(aq)?3KCl(aq)+Fe(SCN)3(aq),平衡时Fe(SCN)3的物质的量浓度与温度T的关系如图所示,则下列说法正确的是( )
已知:FeCl3(aq)+3KSCN(aq)?3KCl(aq)+Fe(SCN)3(aq),平衡时Fe(SCN)3的物质的量浓度与温度T的关系如图所示,则下列说法正确的是( )| A、A点与B点相比,A点的c( Fe3+)大 |
| B、加入KCl固体可以使溶液由D点变到C点 |
| C、反应处于D点时,一定有υ(正)<υ(逆) |
| D、若T1、T2温度下的平衡常数分别为K1、K2,则K1<K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、离子结构示意图: 可以表示16O2-,也可以表示18O2- 可以表示16O2-,也可以表示18O2- |
B、比例模型: 可以表示甲烷分子,也可以表示四氯化碳分子 可以表示甲烷分子,也可以表示四氯化碳分子 |
C、氯化铵的电子式为: |
| D、CO2的结构式为:O-C-O |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、途径②增大02浓度可提高SO2转化率 |
| B、含l mol H2S04的浓溶液与足量NaOH反应,放出的热量即为中和热 |
| C、途径②中S02和S03均属于酸性氧化物 |
| D、若△Hl<△H2+△H3,则2H202(aq)=2H20(1)+02 (g)为放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、三种元素都是非金属元素 |
| B、由三种元素形成的物质既含离子键又含共价键 |
| C、三种化合物都是共价化合物 |
| D、各1mol的M、N与水反应所得气体体积比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯化铝溶液与少量NaOH溶液反应Al3++3OH-=Al(OH)3↓ |
| B、Al(OH)3溶于NaOH溶液中:Al(OH)3+OH-=AlO2-+2H2O |
| C、NaAlO2溶液中通入过量的CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
| D、Al2O3粉末溶于NaOH溶液中:Al2O3+2OH-=2AlO2-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、肯定不存在的离子是Fe3+、Cu2+、NH4+、SO42-、CO32- |
| B、肯定存在的离子是Na+、K+、CO32-、Br- |
| C、无法确定原溶液中是否存在Cl- |
| D、若步骤④改用BaCl2溶液和盐酸的混合溶液,则对溶液中离子的判断无影响 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com