
下列说法中正确的是( )
|
| A. | 所有主族元素正化合价数,等于它的族序数 |
|
| B. | ⅦA族元素的原子随核电荷数的增加,得电子能力逐渐减弱 |
|
| C. | ⅠA、ⅡA族元素的阳离子与同周期稀有气体元素的原子具有相同的核外电子排布 |
|
| D. | 前三周期元素中共有非金属元素12种 |
考点:
元素周期律和元素周期表的综合应用.
专题:
元素周期律与元素周期表专题.
分析:
A、一般来说,主族元素最高正化合价等于其族序数(但F没有正价);
B、同主族元素自上而下,半径增大,得电子能力逐渐减弱;
C、ⅠA、ⅡA族元素的原子失掉最外层电子形成阳离子;
D、对过度元素以外元素,最外层电子数≤该元素原子的电子层数的为非金属(H除外),最外层电子数大于该元素原子的电子层数的为非金属,每周期含有的主族金属元素数目为周期数(第一周期除外),非金属为8﹣周期数(第一周期除外).
解答:
解:A、F没有正价,且有的非金属元素有多种正价,如N有+1、+2、+3、+4、+5价,故A错误;
B、F、Cl、Br、I原子电子层依次增多,半径依次增大,对最外层电子吸引能力逐渐减弱,所以得电子能力逐渐降低,故B正确;
C、H+最外层没有电子,其它ⅠA、ⅡA族元素的阳离子比同周期稀有气体元素的原子的核外电子排布少一个电子层,所以ⅠA、ⅡA族元素的阳离子与上一周期稀有气体元素的原子具有相同的核外电子排布(氢元素除外),故C错误;
D、第一周期有2种,第二周期有8﹣2=6种,第三周期有8﹣3=5种,所以前三周期元素中共有非金属元素2+6+5=13种,故D错误.
故选B.
点评:
本题考查学生元素周期律、周期表知识,可以根据所学知识进行回答,难度不大.注意特殊性,熟练掌握元素周期表.


科目:高中化学 来源: 题型:
某温度下,密闭容器中发生反应aX(g)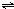 bY(g)+cZ(g),达到平衡后,保持温度不变,将容器的容积压缩到原来容积的一半,当达到新平衡时,物质Y和Z的浓度均是原来的1.8倍.则下列叙述正确的是( )
bY(g)+cZ(g),达到平衡后,保持温度不变,将容器的容积压缩到原来容积的一半,当达到新平衡时,物质Y和Z的浓度均是原来的1.8倍.则下列叙述正确的是( )
|
| A. | 可逆反应的化学计量数数:a>b+c |
|
| B. | 压缩容器的容积时,v正增大,v逆减小 |
|
| C. | 达到新平衡时,物质X的转化率减小 |
|
| D. | 达到新平衡时,混合物中Z的质量分数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、T四种原子序数递增的短周期元素,其部分性质或结构如下:
元素编号 元素性质或原子结构
X 形成的简单阳离子核外无电子
Y 元素的气态氢化物和它的最高价氧化物对应的水化物能发生化合反应
Z 元素在周期表的族序数等于周期序数的3倍
T 同周期元素中形成的简单离子半径最小
下列说法正确的是( )
A. 原子半径大小顺序:T>Z>Y>X
B. 常温下,T的单质与Y的最高价氧化物对应水化物的浓溶液反应生成氢气
C. X分别与Y、Z均可形成既含极性键又含非极性键的化合物
D. 由X、Y和Z三种元素构成的强电解质,对水电离均起抑制作用
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质的分类正确的是( )
|
| A. | 共价化合物﹣﹣硫酸、纯碱、水 | B. | 分散系﹣﹣空气、水玻璃、盐酸 |
|
| C. | 非电解质﹣﹣液氯、乙醇、NH3 | D. | 强氧化剂﹣﹣盐酸、硫酸、硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列氧化还原反应中,水作为氧化剂的是( )
|
| A. | 3NO2+H2O═2HNO3+NO | B. | CO+H2O |
|
| C. | 2Na2O2+2H2O═4NaOH+O2↑ | D. | 2F2+2H2O═4HF+O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组中每种物质都既有离子键又有共价键的一组是( )
|
| A. | NaOH H2SO4 (NH4)2SO4 | B. | MgO Na2SO4 HNO3 |
|
| C. | Na2O2 KOH Na3PO4 | D. | HCl Fe2O3 MgCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知常温下在溶液中可发生如下两个离子反应:
Ce 4+ +Fe 2+ ====Fe 3+ +Ce 3+
Sn 2+ +2Fe 3+ ====2Fe 2+ +Sn 4+
由此可以确定Fe 2+ 、Ce 3+ 、Sn 2+ 三种离子的还原性由强到弱的顺序是( )
A.Sn 2+ 、Fe 2+ 、Ce 3+ B.Sn 2+ 、Ce 3+ 、Fe 2+
C.Ce 3+ 、Fe 2+ 、Sn 2+ D.Fe 2+ 、Sn 2+ 、Ce 3+
查看答案和解析>>
科目:高中化学 来源: 题型:
下列方法能达到实验目的是( )
A. 用浓硫酸干燥NH3
B. 用四氯化碳萃取碘水中的碘单质
C. 用NaOH固体干燥Cl2
D. 将Na在O2中燃烧以制取Na2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com