
分析 (1)赤铁矿的主要成分为氧化铁,工业上用一氧化碳还原赤铁矿冶炼铁,同时生成二氧化碳,根据元素守恒书写化学方程式;
(2)在氧化还原反应中元素化合价降低的作氧化剂,根据氧化还原反应方程中元素的化合价的变化等于转移电子数目进行判断;
(3)刻制印刷电路时,用FeCl3溶液与铜反应生成亚铁离子和铜离子,根据电荷守恒和元素守恒书写反应的离子方程;
解答 解:(1)赤铁矿的主要成分为氧化铁,化学式为Fe2O3,工业上用一氧化碳还原赤铁矿冶炼铁,同时生成二氧化碳,反应的化学方程式为Fe2O3+3CO$\frac{\underline{\;\;△\;\;}}{\;}$2Fe+3CO2 ,
故答案为:Fe2O3;Fe2O3+3CO$\frac{\underline{\;\;△\;\;}}{\;}$2Fe+3CO2 ;
(2)在反应14CuSO4+5FeS2+12H2O═7Cu2S+5FeSO4+12H2SO4中,铜从+2价降为+1价,硫从-1价降为-2价,所以反应中氧化剂为CuSO4和FeS2,反应中化合价降低的总数为14×1+7×1=21,即当有5molFeS2发生反应时,电子转移数为21mol,
故答案为:CuSO4和FeS2;21mol;
(3)刻制印刷电路时,用FeCl3溶液与铜反应生成亚铁离子和铜离子,反应的离子方程为Cu+2Fe3+=2Fe2++Cu2+,
故答案为:Cu+2Fe3+=2Fe2++Cu2+.
点评 本题考查离子反应方程式的书写、氧化还原反应分析等,为高考常见题型,把握发生的化学反应为解答的关键,侧重氧化还原反应的考查,注意离子反应的书写方法,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
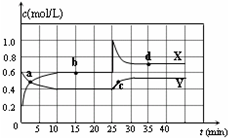 已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.在恒温条件下将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应物浓度随时间变化关系如图.下列说法正确的是( )
已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.在恒温条件下将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应物浓度随时间变化关系如图.下列说法正确的是( )| A. | 图中Y曲线是表示NO2浓度随时间的变化曲线 | |
| B. | 前10 min内v(N2O4)为0.1 mol/( L•min) | |
| C. | 25 min时,导致平衡移动的原因是将密闭容器的体积缩小为1L | |
| D. | 25 min时,导致平衡移动的原因是向容器通入适量NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
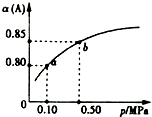 一定温度下,向容积为1L的密闭容器中加入0.5molA和0.25molB,发生反应:2A(g)+B(g)?2C(?),达到平衡时,放出热量Q1kJ.保持温度不变,A的平衡转化率(α)与体系总压强(p)的关系如图所示.则下列说法正确的是( )
一定温度下,向容积为1L的密闭容器中加入0.5molA和0.25molB,发生反应:2A(g)+B(g)?2C(?),达到平衡时,放出热量Q1kJ.保持温度不变,A的平衡转化率(α)与体系总压强(p)的关系如图所示.则下列说法正确的是( )| A. | 若容器内气体的密度保持不变,说明反应一定达到平衡状态 | |
| B. | 若在相同条件下,改为只加入0.5 mol C,则反应达到平衡反,放出热量Q1kJ | |
| C. | 平衡状态由a变到b时,则化学平衡常数K(a)=K(b) | |
| D. | 由图象可知,产物C一定是气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体密度 | B. | 容器内气体的压强 | ||
| C. | 混合气体的平均相对分子质量 | D. | A的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知 H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,则 H2SO4和Ba(OH)2反应的反应热△H=2×(-57.3)kJ•mol-1 | |
| B. | 葡萄糖的燃烧热是2800 kJ•mol-1,则 $\frac{1}{2}$C6H12O6(s)+3O2(g)═3CO2(g)+3H2O(l)△H=-1400kJ•mol-1 | |
| C. | H2(g)的燃烧热是285.8 kJ•mol-1,则 2H2O(g)═2H2(g)+O2(g)△H=+571.6 kJ•mol-1 | |
| D. | 燃料电池中将甲醇蒸气转化为氢气的热化学方程式是 CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)△H=-192.9 kJ•mol-1,则 CH3OH(g)的燃烧热为 192.9 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| B. | PM2.5表面积大,能吸附大量的有毒有害物质,对人的肺功能造成很大危害 | |
| C. | 二氧化硅广泛应用于太阳能电池、计算机芯片 | |
| D. | 汽车尾气中含有大量大气污染物,这是汽油不完全燃烧造成的 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 共价键 | N≡N | H-H | N-H |
| 键能(kJ/mol) | 946 | 436 | 390.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com