
【题目】雾霾严重影响人们的生活与健康。某地区的雾霾中可能含有如下可溶性无机离子:Na+、NH4+、Mg2+、Al3+、SO42-、NO3-、Cl-。某同学收集了该地区的雾霾,经必要的预处理后得试样溶液,设计并完成了如下的实验:
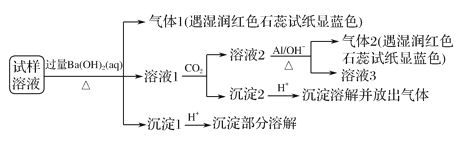
已知:3NO![]() +8Al+5OH-+2H2O
+8Al+5OH-+2H2O![]() 3NH3↑+8AlO
3NH3↑+8AlO![]() ,根据以上的实验操作与现象,该同学得出的结论不正确的是( )
,根据以上的实验操作与现象,该同学得出的结论不正确的是( )
A. 试样中肯定存在NH![]() 、Mg2+、SO
、Mg2+、SO![]() 和NO
和NO![]()
B. 试样中一定不含Al3+
C. 试样中可能存在Na+、Cl-
D. 该雾霾中可能存在NaNO3、NH4Cl和MgSO4
【答案】B
【解析】试样溶液中加入过量Ba(OH)2并加热,生成的气体1,该气体1可能是NH3,则试样中含有NH4+;向滤液中通入CO2,得到溶液2、沉淀2,溶液2中加入Al,NO3-+A1+OH-+H2O→NH3↑+[Al(OH)4]-,生成气体2,该气体是NH3,根据已知条件知,溶液2中含有NO3-,根据元素守恒知,原溶液中含有NO3-;滤液1中通入CO2,得到沉淀2,向沉淀2中加入酸,沉淀溶解并放出气体,说明沉淀2是碳酸钡等难溶性碳酸盐;沉淀1加入酸后,沉淀部分溶解,硫酸钡不溶于酸,说明原来溶液中含有SO42-,能和过量Ba(OH)2反应生成能溶于酸的沉淀,根据离子知,该沉淀为Mg(OH)2,所以溶液中含有Mg 2+,
A、根据以上分析可知溶液中含有NH4+、Mg2+、SO42-和NO3-,故A正确;B.通过以上分析知,试样中不能确定是否含有Al3+,故B错误;C.根据实验无法确定是否含有Na+、Cl-,所以溶液中可能含有Na+、Cl-,,故C正确;D.根据以上分析可知溶液中含有NH4+、Mg2+、SO42-和NO3-,则该雾霾中可能存在NaNO3、NH4Cl和MgSO4,故D正确;故选D.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种元素的原子序数依次增大,A原子无中子,B的单质在空气中含量最多,C、D元素同主族且原子序数D为C的二倍,E元素的价电子排布式为(n﹣l)d10+6ns1 , 回答下列问题:
(1)元素B在周期表中的位置是 .
(2)D元素基态原子的外围电子排布式为 .
(3)BC ![]() 的立体构型为 .
的立体构型为 .
(4)A元素与C元素形成两种常见的化合物,其原子个数比分别为2:1和1:1,两种化合物可以任意比互溶,原因是;其中一种化合物可在酸性条件下将KMnO4还原为Mn2+ , 写出相关反应的离子方程式:
(5)将过量BA3气体通入含E2+溶液中充分反应后生成的二价阳离子是(填离子符号),Imol该离子中含σ键为mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温度下,体积均为1L的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g)![]() 2NH3(g) △H=-92.6kJ/mol.测得数据如表
2NH3(g) △H=-92.6kJ/mol.测得数据如表
容器编号 | 起始时各物质物质的量/mol | 达到平衡时体系能量的变化 | ||
N2 | H2 | NH3 | ||
(1) | 2 | 3 | 0 | 27.78kJ |
(2) | 1.6 | 1.8 | 0.8 | Q |
下列叙述不正确的是
A.容器(1)(2)反应达平衡时压强相等
B.容器(2)中反应开始时v(正)>v(逆)
C.容器(2)中反应达平衡时,吸收的热量Q为9.26kJ
D.若条件为“绝热恒容”,容器(1)中反应达平衡时n(NH3)<0.6mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关氧化还原反应的叙述错误的是
A.复分解反应一定不是氧化还原反应
B.氧化还原反应一定有元素化合价的升降
C.氧化还原反应中氧化剂和还原剂可能是同一种物质
D.氧化剂失电子,被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】霉酚酸酯(MMF)是器官移植中抑制细胞增殖最常用的药物.下列说法正确的是( ) 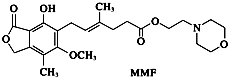
A.MMF能溶于水
B.1 mol MMF能与含3 mol NaOH的水溶液完全反应
C.1 mol MMF能与6 mol氢气发生加成反应
D.MMF能发生取代反应和消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用括号中注明的方法分离下列各组混合物,其中不正确的是( )
A. 汽油和煤油(蒸馏) B. 食盐中的沙子(溶解过滤)
C. 氯化钠和水(过滤) D. 花生油和水(分液)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用硫酸厂烧渣(含铁的氧化物和少量FeS及SiO2)制碱式硫酸铁的流程如下:

(1)SO2与过量NaOH溶液反应的离子方程式为_____________。
(2)滤渣的主要成分为_________(填化学式)。
(3)反应1中加双氧水的目的是将Fe2+氧化为Fe3+,该反应的离子方程式为________。
(4)碱式硫酸铁的化学式为Fex(OH)y(SO4)z·nH2O,为确定其组成进行如下实验:
①称取1.6920g样品溶于足量的稀盐酸中;
②加足量的BaCl2溶液,过滤、洗涤、干燥、称重,得固体质量为2.3300g;
③向步骤②的滤液中加过量的NaOH溶液,过滤、洗涤、灼烧、称重,得固体质量为0.6400g。
根据以上实验数据确定该碱式硫酸铁的化学式_________(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种金属混合粉末15g,与足量的盐酸反应时生成11.2L H2(标况下),符合上述情况的金属混合物是( )
A. Mg、Fe B. Zn、Ag C. Fe、Zn D. Mg、Al
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com