
 “奥运会”严格禁止运动员服用兴奋剂.关于某种兴奋剂(结构简式如图)的以下说法中,正确的是( )
“奥运会”严格禁止运动员服用兴奋剂.关于某种兴奋剂(结构简式如图)的以下说法中,正确的是( )| A、该物质属于芳香烃 |
| B、该物质所有原子都在同一平面上 |
| C、该物质的分子式为C20H25O3 |
| D、1mol该物质最多能与7mol H2加成 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| 过程ⅣB溶液中含有的离子 | 过程ⅥB溶液中含有的离子 | |
| 甲 | 有Fe3+无Fe2+ | 有SO42- |
| 乙 | 既有Fe3+又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、强酸溶液产生较多的氢气 |
| B、两者产生等量的氢气 |
| C、无法比较两者产生氢气的量 |
| D、弱酸溶液产生较多的氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、所加烧碱溶液的pH=13.0 |
| B、所得溶液中c(Mg2+)=5.6×10-10mol/L |
| C、所得溶液中c(H+)=1.0×10-13mol/L |
| D、所得溶液中由水电离产生的c(OH-)=1.0×10-13mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、把电能转变为化学能,使溶液发生氧化还原反应 |
| B、电子从活泼金属流向不活泼金属,不活泼金属为负极 |
| C、外电路中电子从负极流向正极 |
| D、正极发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
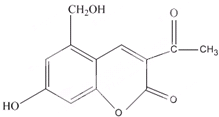
| A、亮菌甲素分子式为C12H11O5 |
| B、1mol亮菌甲素最多能与6mol H2发生加成反应 |
| C、1mol亮菌甲素与NaOH溶液反应,最多消耗3mol NaOH |
| D、亮菌甲素具有弱酸性体现了羟基对苯环的影响 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com