
【题目】连二亚硫酸钠(Na2S2O4)俗称保险粉,是工业上重要的还原性漂白剂,也是重要的食品抗氧化剂。某学习小组模拟工业流程设计实验制取保险粉。
已知:Na2S2O4是白色固体,还原性比Na2SO3强,易与酸反应(2S2O42-+4H+=3SO2↑+S↓+2H2O)。
(一)锌粉法
步骤1:按如图方式,温度控制在40~45℃,当三颈瓶中溶液pH在3~3.5时,停止通入SO2,反应后得到ZnS2O4溶液。
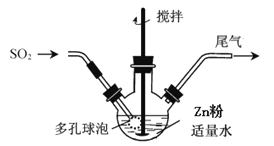
步骤2:将得到的ZnS2O4溶液加入NaOH溶液中,过滤,滤渣为Zn(OH)2,向滤液中加入一定量食盐,立即析出Na2S2O42H2O晶体。
步骤3:,经过滤,用乙醇洗涤,用120~140℃的热风干燥得到Na2S2O4。
(二)甲酸钠法
步骤4:按上图方式,将装置中的Zn粉和水换成HCOONa、Na2CO3溶液和乙醇。温度控制在70~83℃,持续通入SO2,维持溶液pH在4~6,经5~8小时充分反应后迅速降温45~55℃,立即析出无水Na2S2O4。
步骤5:经过滤,用乙醇洗涤,干燥得到Na2S2O4。
回答下列问题:
(1)步骤1容器中发生反应的化学方程式是______;容器中多孔球泡的作用是______。
(2)步骤2中“向滤液中加入一定量食盐,立即析出Na2S2O42H2O晶体”的原理是(用必要的化学用语和文字说明)______。
(3)两种方法中控制温度的加热方式是______。
(4)根据上述实验过程判断,Na2S2O4在水、乙醇中的溶解性为:______。
(5)甲酸钠法中生成Na2S2O4的总反应为______。
(6)两种方法相比较,锌粉法产品纯度高,可能的原因是______。
(7)限用以下给出的试剂,设计实验证明甲酸钠法制得的产品中含有Na2SO4。
稀盐酸、稀硫酸、稀硝酸、AgNO3溶液、BaCl2溶液______。
【答案】H2O+SO2=H2SO3,Zn+2H2SO3![]() ZnS2O4+2H2O或Zn+2SO2
ZnS2O4+2H2O或Zn+2SO2![]() ZnS2O4 增大气体与溶液的接触面积,加快气体的吸收速率 溶液中存在:Na2S2O4(s)
ZnS2O4 增大气体与溶液的接触面积,加快气体的吸收速率 溶液中存在:Na2S2O4(s)![]() Na2S2O4(aq)
Na2S2O4(aq)![]() 2Na+(aq)+
2Na+(aq)+![]() (aq)[或Na2S2O4(s)
(aq)[或Na2S2O4(s)![]() 2Na+(aq)+
2Na+(aq)+![]() (aq)],增大c(Na+),平衡向逆反应方向移动 水浴加热 Na2S2O4在水中溶解度较大,在酒精中溶解度较小 2HCOONa+4SO2+Na2CO3=2Na2S2O4+H2O+3CO2 Zn(OH)2难溶于水,易与Na2S2O4分离 取少量产品配成稀溶液,加入足量稀盐酸,充分反应后静置,取上层清液,滴加BaCl2溶液,有白色沉淀生成,则可确定产品中含有Na2SO4
(aq)],增大c(Na+),平衡向逆反应方向移动 水浴加热 Na2S2O4在水中溶解度较大,在酒精中溶解度较小 2HCOONa+4SO2+Na2CO3=2Na2S2O4+H2O+3CO2 Zn(OH)2难溶于水,易与Na2S2O4分离 取少量产品配成稀溶液,加入足量稀盐酸,充分反应后静置,取上层清液,滴加BaCl2溶液,有白色沉淀生成,则可确定产品中含有Na2SO4
【解析】
合成保险粉的反应物为Zn、SO2、H2O,根据温度控制在40~45℃,当三颈瓶中溶液pH在3~3.5时,停止通入SO2,反应后得到ZnS2O4溶液,据此分析解答。
(1)合成保险粉的反应物有Zn、SO2、H2O,根据温度控制在40~45℃,当三颈瓶中溶液pH在3~3.5时,说明发生了:H2O+SO2=H2SO3反应,最后反应得到ZnS2O4溶液,说明又发生了:Zn+2H2SO3![]() ZnS2O4+2H2O反应,总过程也可以写成:Zn+2SO2
ZnS2O4+2H2O反应,总过程也可以写成:Zn+2SO2![]() ZnS2O4,多孔球泡可以增大气体与液体的接触面积,加快气体的吸收速率;
ZnS2O4,多孔球泡可以增大气体与液体的接触面积,加快气体的吸收速率;
(2)溶液中存在:Na2S2O4(s)![]() Na2S2O4(aq)
Na2S2O4(aq)![]() 2Na+(aq)+
2Na+(aq)+![]() (aq)[或Na2S2O4(s)
(aq)[或Na2S2O4(s)![]() 2Na+(aq)+
2Na+(aq)+![]() (aq)],增大c(Na+),平衡向逆反应方向移动,所以向滤液中加入一定量食盐,立即析出Na2S2O42H2O晶体;
(aq)],增大c(Na+),平衡向逆反应方向移动,所以向滤液中加入一定量食盐,立即析出Na2S2O42H2O晶体;
(3)根据温度控制在40~45℃可知需要控制温度的加热方式一般是水浴加热;
(4)根据步骤2中将得到的ZnS2O4溶液加入NaOH溶液中,过滤,滤渣为Zn(OH)2,向滤液中加入食盐,才析出Na2S2O42H2O晶体,可知Na2S2O4在水中溶解度较大;根据步骤5析出的晶体用无水乙醇洗涤的目的是使晶体迅速干燥,避免溶解而减少损耗,可知其在酒精中溶解度较小;
(5)由题意可知甲酸钠、二氧化硫、碳酸钠反应生成Na2S2O4,同时生成二氧化碳,反应的方程式为2HCOONa+4SO2+Na2CO3=2Na2S2O4+H2O+3CO2;
(6)锌粉法产品纯度高,可能的原因是Zn(OH)2难溶于水,易与Na2S2O4分离;
(7)设计实验证明甲酸钠法制得的产品中含有Na2SO4,要避免Na2S2O4干扰,所以取少量产品配成稀溶液,加入足量稀盐酸,充分反应后静置,取上层清液,滴加BaCl2溶液,有白色沉淀生成,则可确定产品中含有Na2SO4。


科目:高中化学 来源: 题型:
【题目】下列对分子性质的解释中,不正确的是( )
A. 碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释
B. 由于乳酸(![]() )中存在一个手性碳原子,导致该物质存在互为镜像的两个手性异构体
)中存在一个手性碳原子,导致该物质存在互为镜像的两个手性异构体
C. HF的稳定性很强,是因为其分子间能形成氢键
D. 由右图可知酸性:H3PO4>HClO,因为H3PO4分子中有1个非羟基氧原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃下,根据三种酸的电离常数,下列判断正确的是
酸 | HX | HY | HZ |
电离常数K | 1×10-7 | 9×10-6 | 1×10-2 |
A.三种酸的强弱关系:HX>HY>HZ
B.相同温度下,0.1 mol/L的NaX、NaY、NaZ溶液,NaZ溶液碱性最强
C.反应HX+Y-=HY+X-能够发生
D.25℃时,0.1 mol/L HX溶液的pH约为4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个2L的密闭容器中,加入4mo1A和2molB进行如下反应:3A(g)+2B(g)![]() 4C(?)+2D(?)。反应一段时间后达到平衡,测得生成1.6molC,且反应前与反应后的气体压强之比为5:4(相同的温度下测量),则下列说法正确的是( )
4C(?)+2D(?)。反应一段时间后达到平衡,测得生成1.6molC,且反应前与反应后的气体压强之比为5:4(相同的温度下测量),则下列说法正确的是( )
A. 该反应的化学平衡常数表达式是![]()
B. 此时,B的平衡转化率是20%
C. 增加C的量,B的平衡转化率不变
D. 增大该体系的压强,平衡向右移动,化学平衡常数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铅蓄电池的工作原理为Pb+PbO2+2H2SO4 ![]() 2PbSO4+2H2O,现用如图装置进行电解(电解液足量),电解中发现Ag电极有气体产生。请回答下列问题。
2PbSO4+2H2O,现用如图装置进行电解(电解液足量),电解中发现Ag电极有气体产生。请回答下列问题。
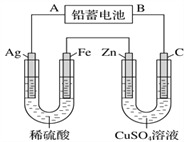
甲池 乙池
(1)B是铅蓄电池的________极,放电过程中A电极反应式:_______________________。
(2)电解后甲池中电解液的pH________(填“减小”“增大”或“不变”)。若甲池中产生气体11.2L(标准状况下),此时乙池中理论上Zn电极最多产生固体________ g。
(3)乙池中 C(碳)电极是_________极。C电极的电极反应式是___________________,反应一段时间后,向乙池中加入一定量的___________(填化学式)固体,能使CuSO4溶液恢复到原浓度。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用化学用语表示Na2CO3+2Cl2===2NaCl+Cl2O+CO2中的相关微粒,其中正确的是( )
A. Na+的结构示意图:![]()
B. Cl2O的结构式:Cl—O—Cl
C. 中子数比质子数多3的氯原子:3517Cl
D. CO2的电子式:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
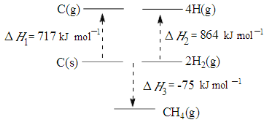
【题目】(1)根据下图中的能量关系,可求得C-H的键能为______________。
(2)X(s)+3Y(g)![]() Z(g)+3W(g) ΔH=-akJ/mol,一定条件下,将2molX和2molY通入2L的恒容密闭容器中,反应10s后达到平衡,测得生成0.5molZ。
Z(g)+3W(g) ΔH=-akJ/mol,一定条件下,将2molX和2molY通入2L的恒容密闭容器中,反应10s后达到平衡,测得生成0.5molZ。
①则10s内,Y的平均反应速率为_____________,第10s时,X的物质的量为__________,Y的浓度为_______,10s内,X和Y反应放出的热量Q为______。
②判断该反应是否达到平衡的依据是__________(填字母)。
A.压强不随时间改变 B.气体的密度不随时间改变
C.c(Y)不随时间改变 D.单位时间里生成Z和W的物质的量之比为1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.标况下,22.4LCl2溶于足量水,所得溶液中Cl2、Cl-、HClO和ClO-四种微粒总数为NA
B.标准状况下,38g3H2O2中含有4NA共价键
C.常温下,将5.6g铁块投入一定量浓硝酸中,转移0.3NA电子
D.一定温度下,1L0.50mol/LNH4Cl溶液与2L0.25mol/LNH4Cl溶液含NH4+的物质的量一定不相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com