
| A. | Na、Mg、Al的第一电离能逐渐增大 | B. | 热稳定性:HF>H2O>NH3 | ||
| C. | S2-、Cl-、K+的半径逐渐增大 | D. | O、F、Ne的电负性逐渐增大 |
分析 A.金属性越强,第一电离能越小,但Mg的最外层为3s电子全满,难以失去电子;
B.非金属性越强,氢化物的稳定性越强;
C.电子层相同时,核电荷数越大,离子半径越小;
D.非金属性越强,电负性越强.
解答 解:A.Mg的最外层为3s电子全满,稳定结构,难以失去电子,第一电离能最大,Na的最小,则第一电离能大小为:Na>Al>Mg,故A错误;
B.非金属性F>O>N,则氢化物稳定性:HF>H2O>NH3,故B正确;
C.S2-、Cl-、K+具有相同的电子层数,核电荷数越大,离子半径越小,则S2-、Cl-、K+的半径逐渐减小,故C错误;
D.非金属性Ne<O<F,则电负性大小为:Ne<O<F,故D错误;
故选B.
点评 本题考查了原子结构与元素周期律的关系,题目难度不大,明确元素周期律内容为解答关键,A为易错点,注意ⅡA族、ⅤA族元素的电负性反常,试题有利于提高学生的灵活应用能力.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:选择题
| A. | 液氯是纯净物,氯水是电解质,漂白粉是混合物 | |
| B. | 氯气可用作消毒剂和漂白剂,是因为氯分子具有强氧化性 | |
| C. | 随着化合价的升高,氯的含氧酸酸性和氧化性均逐渐增强 | |
| D. | 不能用pH试纸测定氯水的pH |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 还原性:X的氢化物>Y的氢化物>Z的氢化物 | |
| B. | 简单离子的半径:Y的离子>Z的离子>M的离子>X的离子 | |
| C. | YX2、M2Y都含有极性键 | |
| D. | Z元素的最高价氧化物的水化物的化学式为H2ZO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
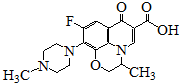
| A. | 能发生加成、取代反应 | |
| B. | 一定条件下,1mol该物质最多消耗5mol H2 | |
| C. | 分子内共有19个氢原子 | |
| D. | 分子内共平面的碳原子多于6个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子中C、H、O个数之比为1:2:3 | B. | 分子中C、H个数之比为1:2 | ||
| C. | 此有机物一定是烃CH4 | D. | 分子中可能含有氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
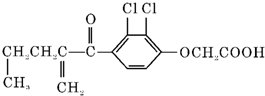
| A. | 利尿酸的衍生物利尿酸甲酯的分子式是C14H14O4Cl2 | |
| B. | 利尿酸不能发生酯化反应 | |
| C. | 1 mol利尿酸能与7 mol H2发生加成反应 | |
| D. | 利尿酸不能与FeCl3溶液发生显色反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com