
| 选项 | A | B | C | D |
| 第一次加入 | Al | Na | Zn | Mg |
| 第二次加入 | K | Mg | Al | Cu |
| A. | A | B. | B | C. | C | D. | D |
分析 1L 0.01mol•L-1的HCl溶液中HCl的物质的量为1L×0.01mol/L=0.01mol,
第一次加入0.02mol金属,分别发生:2Na+2HCl=2NaCl+H2↑、2Al+6HCl=2AlCl3+3H2↑、Zn+2HCl=ZnCl2+2H2↑、Mg+2HCl=MgCl2+H2↑,由方程式可知盐酸完全反应,
第二次再加入金属时,B、C、D中均没有气体再生成,而A中K发生反应:2K+2H2O=2KOH+H2↑,以此解答该题.
解答 解:1L 0.01mol•L-1的HCl溶液中HCl的物质的量为1L×0.01mol/L=0.01mol,
第一次加入0.02mol金属,分别发生:2Na+2HCl=2NaCl+H2↑、2Al+6HCl=2AlCl3+3H2↑、Zn+2HCl=ZnCl2+2H2↑、Mg+2HCl=MgCl2+H2↑,由方程式可知盐酸完全反应,
可知HCl不足,故Na生成0.01mol氢气,Al、Zn、Mg生成氢气为0.005mol,
剩余Al为0.02mol-$\frac{0.01}{3}$mol=$\frac{0.05}{3}$mol,生成氯化铝为$\frac{0.01}{3}$mol.
第二次再加入金属时,B、C、D中均没有气体再生成,而A中K发生反应:2K+2H2O=2KOH+H2↑,生成0.005mol氢气,且发生2Al+2KOH+2H2O=2KAlO2+3H2↑,则A生成的氢气大于0.01mol,生成氢气最多,
故选A.
点评 本题考查化学方程式的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,主要把握物质的性质以及反应的化学方程式,结合方程式计算该题,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | (m-16)g | B. | (m+16)g | C. | (m-32)g | D. | 16g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 保持容器容积不变,向其中加入1 mol N2(N2不参加反应),反应速率加快 | |
| B. | 提高起始的反应温度,正反应速率加快,逆反应速率减慢,平衡正向移动 | |
| C. | 保持容器内气体压强不变,向其中加入1 mol Ne,反应速率加快,平衡正向移动 | |
| D. | 保持容器内气体压强不变,向其中加入1 mol H2(g)和1 mol I2(g),反应速率不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 目 的 | 分离方法 | 原 理 |
| A | 分离溶于水中的碘 | 乙醇萃取 | 碘在乙醇中的溶解度较大 |
| B | 分离乙酸乙酯和乙醇 | 分液 | 乙酸乙酯和乙醇的密度不同 |
| C | 除去乙烷中混有的乙烯 | 酸性高锰酸钾溶液洗气 | 乙烯与酸性高锰酸钾溶液反应而乙烷不能 |
| D | 除去乙酸乙酯中混有的乙酸 | 用饱和碳酸钠溶液洗涤后分液 | 乙酸能与碳酸钠反应生成溶于水的盐 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
| n(X) | n(Y) | n(M) | ||
| ① | 700 | 0.40 | 0.10 | 0.090 |
| ② | 800 | 0.10 | 0.40 | 0.080 |
| ③ | 800 | 0.20 | 0.20 | a |
| ④ | 800 | 0.10 | 0.10 | b |
| A. | 实验①中,若5min时测得n(M)=0.050mol,则0至5min时间内,用N表示的平均反应速率υ(N)=1.0×10-2mol/(L•min) | |
| B. | 实验②中,该反应的平衡常数K=2.0 | |
| C. | 实验③中,达到平衡时,X的转化率为50% | |
| D. | 实验④中,达到平衡时,b<0.05 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
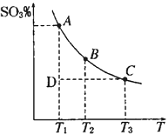 硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)?2SO3(g),混合体系中SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题:
硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)?2SO3(g),混合体系中SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 一定温度下,反应MgCl2(l)=Mg(l)+Cl2(g)的△H>0、△S>0 | |
| B. | 水解反应NH4++H2O?NH3•H2O+H+达到平衡后,升高温度平衡逆向移动 | |
| C. | AlCl3溶液蒸干、灼烧至恒重,最终剩余固体是AlCl3 | |
| D. | 对于反应2H2O2=2H2O+O2↑,加入MnO2或升高温度都能加快O2的生成速率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com