
分析 (1)常温下,Kw=10-14,某强酸溶液pH=a,则该酸溶液中氢离子浓度为10-a mol/L,强碱溶液pH=b,则碱溶液中氢氧根离子浓度=10b-14 mol/L,溶液呈中性说明氢离子和氢氧根离子的物质的量相等.
(2)酸、碱溶液抑制了水的电离,酸溶液中的氢氧根离子、碱溶液中的氢离子是水电离的,根据溶液中氢离子、氢氧根离子浓度计算出水电离的氢氧根离子浓度,然后进行判断,注意醋酸为弱酸,醋酸电离的氢离子小于0.1mol/L;
(3)先根据水的离子积常数计算氢氧化钡溶液中c(OH-),再根据盐酸和氢氧化钡之间的关系计算氢氧化钡和盐酸的体积之比.
解答 解:(1)25℃时,Kw=10-14,某强酸溶液pH=a,则该酸溶液中氢离子浓度为10-a mol/L,强碱溶液pH=b,则碱溶液中氢氧根离子浓度=10b-14 mol/L,溶液呈中性说明氢离子和氢氧根离子的物质的量相等,酸的体积为V(酸),碱的体积为V(碱),10-a mol/L×V(酸)L=10b-14 mol/L×V(碱)L,则V(酸)=10a+b-14 V(碱),而a+b=12,故V(碱)=100V(酸),即:V(酸):V(碱)=1:100,
故答案为:1:100;
(2)现有浓度均为0.1mol/L的下列溶液:①氢氧化钡;②醋酸;③氢氧化钠;④盐酸,这四种溶液对水的电离都起到抑制作用;由水的离子积Kw=c(H+)•c(OH-)=10-14,可计算①中c(OH-)=0.2mol/L,氢离子只能由水电离,水电离出的c(OH-)=c(H+)=$\frac{1×1{0}^{-14}}{0.2}$=5×10-14mol/L;②中氢氧根离子只能由水电离,由于氢离子浓度小于0.1mol/L,则水电离出的c(OH-)>10-13mol/L;③中c(OH-)=0.1mol/L,氢离子只能由水电离,水电离出的c(OH-)=c(H+)=10-13mol/L;④盐酸中氢氧根离子是水电离的,溶液中氢离子为0.1mol/L,则水电离的氢氧根离子浓度为c(OH-)=10-13mol/L,所以四种溶液中由水电离出的OH-浓度由大到小的顺序是:②>③=④>①,
故答案为:②>③=④>①;
(3)将pH=8的Ba(OH)2溶液中c(OH-)=10-4 mol/L,pH=5的稀盐酸中c(H+)=10-5 mol/L,
设氢氧化钡的体积为x,盐酸的体积为y,100℃的恒温,欲使混合溶液pH=7,溶液呈碱性,
c(OH-)=$\frac{1{0}^{-12}}{1{0}^{-7}}$mol/L=10-5 mol/L,c(OH-)=$\frac{1{0}^{-4}x-1{0}^{-5}y}{x+y}$=10-5 mol/L,
解得:x:y=2:9,
故答案为:2:9.
点评 本题考查了酸碱混合的定性判断及溶液pH的计算,题目难度中等,涉及水的电离及其影响、酸碱混合的定性判断、溶液pH的计算等知识,注意掌握溶液酸碱性与溶液pH的关系及计算方法,明确酸碱溶液抑制了水的电离,酸溶液中的氢氧根离子、碱溶液中的氢离子是水电离的.


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
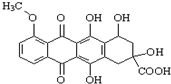 ,有关该物质的说法不正确的是( )
,有关该物质的说法不正确的是( )| A. | 该化合物属于芳香族化合物,分子式为C20H16O9 | |
| B. | 能发生消去反应、酯化反应、取代反应、氧化反应、水解反应等 | |
| C. | 能分别与金属Na、NaHCO3溶液反应 | |
| D. | 1 mol该有机物与足量NaOH溶液反应,消耗3 mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
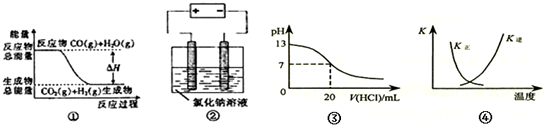
| A. | 图①表示可逆反应CO(g)+H2O(g)?CO2(g)+H2(g)中的△H大于0 | |
| B. | 图②是石墨为电极电解氯化钠稀溶液,阴、阳两极产生气体体积之比一定为1:1 | |
| C. | 图③表示25℃,0.1 mol•L-1盐酸滴定20 mL 0.1 mol•L-1 NaOH溶液,pH随加入酸体积的变化 | |
| D. | 图④表示2SO2(g)+O2(g)?2SO3(g)△H<0 正、逆反应平衡常数K随温度的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 操作 | 现象 | 结论 |
| 将有色鲜花瓣放入干燥的Cl2中 | 过一会儿鲜花瓣褪色 | (1)湿润的氯气具有漂白性 |
| 将干燥的有色布条放入新制的氯水中 | 过一段时间该布条褪色 | |
| 将有色干花瓣放入干燥的Cl2中 | (2)不褪色 | (4)干燥的氯气不具有漂白性 |
| 将干燥的有色布条放入干燥的Cl2中 | (3)不褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 少量碳酸钠固体 | B. | 少量硫酸铜固体 | C. | 硝酸钾溶液 | D. | 氯化钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
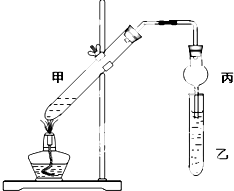
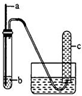 按如图所示装置选取不同试剂组进行实验,下列实验现象预期和结论均正确的是
按如图所示装置选取不同试剂组进行实验,下列实验现象预期和结论均正确的是| a | b | 实验现象预期 | 结论 | |
| A | 铜丝 | 浓硝酸 | 试管c中有大量红棕色气体 | 硝酸有强氧化性 |
| B | 木条 | 18.4mol/L硫酸 | 木条变黑 | 浓硫酸有酸性及氧化性 |
| C | 生铁 | 饱和NaCl溶液 | 导管中发生倒吸 | 生铁发生吸氧腐蚀 |
| D | 铁丝 | 含少量HCl的H2O2溶液 | 试管c中有大量无色气体 | 该反应中铁做催化剂 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 89.6mL | B. | 112mL | C. | 224 mL | D. | 448mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com