
| A. | 失去电子的反应为还原反应 | |
| B. | 含有氧元素的物质是氧化剂 | |
| C. | 氧化剂得到电子的数目和还原剂失去的电子的数目一定相等 | |
| D. | 氧化剂和还原剂不可能是同一种物质 |
分析 氧化还原反应中,氧化剂得电子被还原,还原剂失电子被氧化,氧化剂和还原剂之间得失电子数目相等,且氧化还原反应可发生在同一种元素之间,氧化剂、还原剂的与是否含有氧元素无关,以此解答该题.
解答 解:A、失电子的物质是还原剂,发生氧化反应,故A错误;
B.氧化剂不一定有氧元素,如氯气,故B错误;
C.氧化还原反应中得失电子守恒,也就是氧化剂得到电子的数目和还原剂失去的电子的数目一定相等,故C正确;
D.氧化剂和还原剂可能是同一物质,如氯气和水的反应,故D错误.
故选C.
点评 本题考查氧化还原反应,熟悉利用元素化合价来分析物质的性质及常见的氧化还原反应是解答本题的关键,学会利用举例的方法来说明选项的正误.


科目:高中化学 来源: 题型:选择题
| A. | 手机上用的锂离子电池属于二次电池 | |
| B. | 铜-锌-稀硫酸电池工作时,当转移2mol电子时,正极区可生成氢气2.24L | |
| C. | 氢氧燃料电池可把化学能转为电能 | |
| D. | 锌锰电池、镍镉电池、化学电池易造成环境污染,而氢氧燃料电池是对环境友好的电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
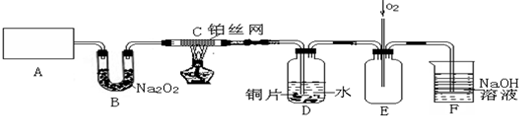
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 微粒半径大小:S2->Cl->Na+>Al3+>F- | |
| B. | 热稳定性大小:SiH4>PH3>NH3 | |
| C. | 相同条件下与水反应的剧烈程度:Rb>K>Na>Li | |
| D. | 酸性强弱顺序:HClO4<H2SO4<H3PO4<H2SiO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可在分液漏斗内用四氯化碳萃取碘酒中的碘单质 | |
| B. | 分液漏斗在使用前只需检查旋塞芯处是否漏水即可 | |
| C. | 在分液漏斗中加入萃取剂后应上下颠倒摇匀使萃取剂与溶质充分接触 | |
| D. | 放出下层液体时,应打开上方的玻璃塞,并使下端管口紧贴烧杯内壁 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
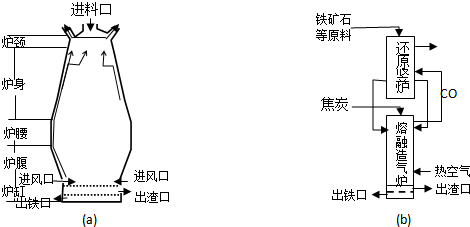
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可以用溴水鉴别丙烯和苯 | |
| B. | 用无水硫酸铜可以检验酒精中是否含有水 | |
| C. | 可以用氢氧化钠溶液鉴别乙醇和乙酸 | |
| D. | 可以用烧灼的方法鉴别真丝布料和纯棉布料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com