
钇(Y)元素常见化合价为+3是激光和超导的重要材料.我国蕴藏着丰富的钇矿石(Y2FeBe2Si2O10),以此矿石为原料生产氧化钇(Y2O3)的主要流程如下:
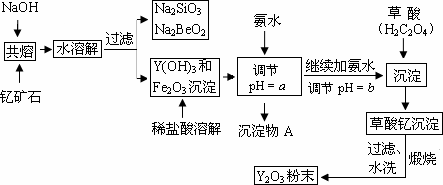
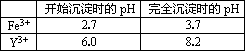
已知:①有关金属离子形成氢氧化物沉淀时的pH如下表:
②在周期表中,铍、铝元素处于第二周期和第三周期的对角线位置,化学性质相似.
(1)钇矿石(Y2FeBe2Si2O10)的组成用氧化物的形式可表示为________.
(2)欲从Na2SiO3和Na2BeO2的混合溶液中制得Be(OH)2沉淀.则
①最好选用盐酸、________(填字母)两种试剂,再通过必要的操作即可实现.
a.NaOH溶液
b.氨水
c.CO2气
d.HNO3
②写出Na2BeO2与足量盐酸发生反应的离子方程式:________.
(3)检验草酸钇沉淀是否洗涤干净的操作方法是________.
(4)10 mL 0.1 mol/L H2C2O4溶液与10 mL 0.1 mol/L NaOH溶液混合后溶液显酸性,溶液中离子浓度由大到小的排列顺序是________.
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 元素 | 有关信息 |
| X | 最外层电子数是次外层的2倍 |
| Y | 元素主要化合价为-2价 |
| Z | 其单质及化合物的焰色为黄色 |
| M | 与X同主族,其单质为半导体材料 |
| N | 其单质在Y单质中燃烧,发出明亮的蓝紫色火焰 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (2010?东城区一模)短周期元素X、Y、Z、M、N原子序数依次增大,有关信息如下:
(2010?东城区一模)短周期元素X、Y、Z、M、N原子序数依次增大,有关信息如下:| 元素 | 有关信息 |
| X | 最外层电子数是次外层的2倍 |
| Y | 元素主要化合价为-2价 |
| Z | 其单质及化合物的焰色为黄色 |
| M | 与X同主族,其单质为半导体材料 |
| N | 其单质在Y单质中燃烧,发出明亮的蓝紫色火焰 |


查看答案和解析>>
科目:高中化学 来源:2012-2013学年辽宁瓦房店高级中学高二上学期期中考试化学试卷(带解析) 题型:填空题
(6分) 短周期元素X、Y、Z、M、N原子序数依次增大,有关信息如下:
| 元素 | 有关信息 |
| X | 最外层电子数是次外层的2倍 |
| Y | 元素主要化合价为-2价 |
| Z | 其单质及化合物的焰色为黄色 |
| M | 与X同主族,其单质为半导体材料 |
| N | 其单质在Y单质中燃烧,发出明亮的蓝紫色火焰 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下表为元素周期表中第四周期的部分元素(从左到右按原子序数递增排列),根据要求回答下列各小题:
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge |
(1)在以上元素的基态原子的电子排布中4s轨道上只有1个电子的元素有 (填元素名称)。
(2)根据元素原子的外围电子排布的特征,可将元素周期表分成五个区域:s区、p区、d区、ds区和f区,以上十二种元素分别属于s区、d区和ds区,则属于s区的元素有 种,属于d区的元素有 种。
(3)试比较:第一电离能I1(Cr) I1(Co)(填“>”、“<”或“=”,下同);
晶格能U(FeO) U(NaCl)(FeO与NaCl的晶胞结构相似)。
(4)钇钡铜氧是一种新型节能高温超导体,其晶胞结构如下图所示,研究发现,此高温超导体中的Cu元素有两种价态,分别为+2价和+3价,Y元素的化合价为+3价,Ba元素的化合价为+2价。

①该物质的化学式为: 。
②该物质中Cu2+与Cu3+的原子个数比为: 。
(5)现有一种含钛的晶体,其组成为TiCl3?6H2O,晶体中Ti3+的配位数为6。为测定该晶体的化学式,进行了如下实验:取一定质量的该晶体(含0.01molTi3+)配成溶液,向其中滴入足量AgNO3溶液,产生白色沉淀,沉淀完全后过滤,经洗涤干燥后称量,质量为2.87g。试推断紫色晶体的化学式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com