
【题目】常温下,将NH4NO3溶于水得无色溶液,为使该溶液中的c(NH ![]() ):c(NO
):c(NO ![]() )=1:1,可以采取的下列措施是( )
)=1:1,可以采取的下列措施是( )
A.加入适量的HNO3 , 抑制NH ![]() 水解
水解
B.加入适量的氨水,使溶液的pH等于7
C.再加入适量的NH4NO3(s)
D.加入适量的NaOH,使溶液的pH等于7
【答案】B
【解析】解:A.加入硝酸,氢离子的浓度增大能抑制铵根离子的水解,但硝酸中有硝酸根离子导致硝酸根离子的浓度增大,铵根离子与硝酸根离子的浓度不是1:1,故A错误.
B.加入氨水使溶液的PH=7,溶液中氢离子浓度等于氢氧根离子浓度,溶液呈中性,溶液中阴阳离子所带的电荷相等,所以c(NH4+):c(NO3﹣)=l:l,故B正确.
C.再加入适量的NH4NO3 , 不能抑制铵根离子的水解,仍存在c(NH4+):c(NO3﹣)小于l:l,故C错误.
D.加入适量的NaOH,使溶液的pH=7,溶液中氢离子浓度等于氢氧根离子浓度,溶液呈中性,溶液中阴阳离子所带的电荷相等,[c(NH4+)+C(Na+)]:c(NO3﹣)=l:l,所以c(NH4+):c(NO3﹣)小于l:l,故D错误.
故选B.


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案科目:高中化学 来源: 题型:
【题目】水是一种重要的自然资源,是人类赖以生存不可缺少的物质.请回答下列问题:
(1)水质优劣直接影响人体健康.天然水在净化处理过程中加入的混凝剂可以是(填两种物质的名称),其净水作用的原理是
(2)水的净化与软化的区别是
(3)硬度为1°的水是指每升水含10mg CaO或与之相当的物质(如7.1mg MgO).若某天然水中c(Ca2+)=1.2×10﹣3mol/L,c(Mg2+)=6×10﹣4mol/L,则此水的硬度为 .
(4)若(3)中的天然水还含有c(HCO3﹣)=8×10﹣4mol/L,现要软化10m3这种天然水,则需先加入Ca(OH)2克,后加入Na2CO3克.
(5)如图是电渗析法淡化海水的原理图,其中,电极A接直流电源的正极,电极B接直流电源的负极. 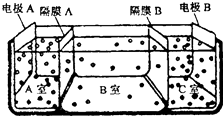
①隔膜A是(填“阴”或“阳”)离子交换膜;
②某种海水样品,经分析含有大量的Na+、Cl﹣ , 以及少量的K+、SO42﹣ . 若用上述装置对该海水进行淡化,当淡化工作完成后,A、B、C三室中所得溶液(或液体)的pH分别为pHa、pHb、pHc , 则其大小顺序为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,不属于氧化还原反应的是( )
A. 3NO2+H2O=2HNO3+NO B. FeCl3+3H2O(沸水) ![]() Fe(OH)3(胶体)+3HCl
Fe(OH)3(胶体)+3HCl
C. SiO2+3C![]() SiC+2CO↑ D. Cu2O+2HCl=Cu+CuCl2+H2O
SiC+2CO↑ D. Cu2O+2HCl=Cu+CuCl2+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述不相符的是( ) 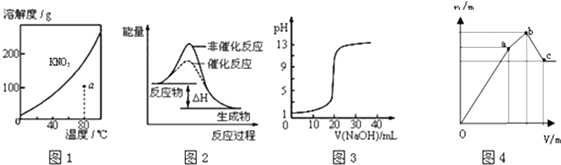
A.图1表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液
B.图2表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化
C.图3表示0.1000molL﹣1NaOH溶液滴定20.00mL0.1000molL﹣1醋酸溶液得到滴定曲线
D.图4 表示向NH4Al(SO4)2溶液中逐滴滴入Ba(OH)2溶液,随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现将600mL稀硫酸等体积分为6份,并向其中5份中分别加入质量不等的Zn粒,并收集生成的氢气,有以下记录结果。(氢气的体积已折算为标准状况)
实验① | 实验② | 实验③ | 实验④ | 实验⑤ | |
Zn质量(g) | 5.0 | 8.0 | 12 | 14 | 16 |
H2体积(L) | 1.72 | 4.14 | 4.48 | 4.48 |
(1)由实验结果可推知,此稀硫酸的物质的量浓度为____________。
(2)实验②收集到H2的体积为____________。
(3)若向第6份稀硫酸中不断加入Zn粒,请在下图中画出H2体积(V)与Zn粒质量(m)的关系图像____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人的胃壁能产生胃液,胃液里含有少量盐酸,称为胃酸。胃过多会导致消化不良和胃痛。抗酸药是一类治疗胃痛的药物,能中和胃里过多的盐酸,缓解胃部的不适。下列物质不能作抗酸药的是( )
A.碳酸氢钠B.氢氧化铝C.碳酸镁D.硫酸钡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意填空
(1)常温下某溶液中由水电离出的离子浓度符合c(H+)c(OH﹣)=1×10﹣20的溶液,其pH为 , 此时水的电离受到
(2)在某温度下,H2O的离子积常数为1×10﹣13 mol2L﹣2 , 则该温度下:100mL 0.1molL﹣1H2SO4溶液与100mL 0.4molL﹣1的KOH溶液混合后,pH= .
(3)已知一溶液有4种离子:X+、Y﹣、H+、OH﹣ , 下列分析结果肯定错误的是
A.c(Y﹣)>c(X+)>c(H+)>c(OH﹣)
B.c(X+)>c(Y﹣)>c(OH﹣)>c(H+)
C.c(H+)>c(Y﹣)>c(X+)>c(OH﹣)
D.c(OH﹣)>c(X+)>c(H+)>c(Y﹣)
(4)在25℃下,将a molL﹣1的氨水与0.01molL﹣1的盐酸等体积混合,反应时溶液中c(NH4+)=c(Cl﹣).则溶液显(填“酸”“碱”或“中”)性;用含a的代数式表示NH3H2O的电离常数Kb= .
(5)水溶液中的行为是中学化学的重要内容.已知下列物质的电离常数值:
HClO:Ka=3×10﹣8 H2CO3:Ka1=4.3×10﹣7 Ka2=5.6×10﹣11;84消毒液中通入少量的CO2 , 该反应的化学方程式为
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com