
已知X、Y和Z三种元素的原子序数之和等于48。X是有机物主要组成元素。X的一种1∶1型气态氢化物分子中既有σ键又有π键。Z是金属元素,Z的核电荷数小于28,且次外层有2个未成对电子。
(1)X在该氢化物中以 方式杂化。X和Y形成的化合物的熔点应该 (填“高于”或“低于”)X氢化物的熔点。
(2)Y在周期表中位于 ;Z4+的核外电子排布式为 。
(3)工业上利用ZO2和碳酸钡在熔融状态下制取化合物M(M可看作一种含氧酸盐)。经X射线分析,M晶体的最小重复单位为正方体(如图),边长为4.03×10-10 m,顶点位置为Z4+所占,体心位置为Ba2+所占,所有棱心位置为O2-所占。
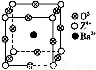
①制备M的化学反应方程式是 (Z用元素符号表示)。
②在M晶体中,Ba2+的氧配位数(Ba2+周围等距且最近的O2-的数目)为 。
③晶体M密度的计算式为ρ= (Z相对原子质量为48)。
(1)sp 高于 (2)第4周期ⅡA族 1s22s22p63s23p6
(3)①TiO2+BaCO3 BaTiO3+CO2↑ ②12
BaTiO3+CO2↑ ②12
③(137+48+3×16)/NA(4.03×10-8)3 g·cm-3
【解析】有机物的主要组成元素X为碳元素,Z元素次外层有2个未成对电子且核电荷数小于28,只能为过渡元素钛22Ti,位于周期表中第4周期ⅣB族。根据原子序数之和为48,可推知Y为20号元素钙。(1)X的该氢化物为乙炔,乙炔为直线形分子,碳原子以sp方式杂化,碳化钙是离子化合物,熔点高于碳的氢化物分子晶体熔点。(2)钙元素在周期表中第4周期ⅡA族。钛离子核外电子排布式为:1s22s22p63s23p6。(3)①用均摊法可以推出M的化学式为BaTiO3,制备BaTiO3化学方程式:TiO2+BaCO3 BaTiO3+CO2↑。②与钡离子紧邻等距的氧离子共有12个。③由1 mol该化合物的体积关系得:
BaTiO3+CO2↑。②与钡离子紧邻等距的氧离子共有12个。③由1 mol该化合物的体积关系得: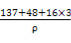 =(4.03×10-8)3NA,整理得ρ=
=(4.03×10-8)3NA,整理得ρ=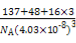 g·cm-3。
g·cm-3。


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源:2014高考化学名师选择题专练 有机物组成练习卷(解析版) 题型:选择题
下列实验或操作不能达到目的的是( )
A.用溴水鉴别乙醇、苯和四氯化碳
B.用稀硫酸和银氨溶液可以检验淀粉已部分水解
C.用饱和碳酸钠溶液除去乙酸乙酯中的少量乙酸
D.用饱和碳酸钠溶液鉴别乙酸乙酯、乙醇和乙酸
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师选择题专练 化学与STSE练习卷(解析版) 题型:选择题
自保定市被世界自然基金会选定为“中国低碳城市发展项目”的首批试点城市之后,“低碳”已经走进百姓生活、城市建设以及经济发展等各个领域,下列有关说法不正确的是( )
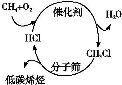
A.太阳能、地热能、核能等均属于新能源
B.“低碳”是指采用含碳量低的烃类化合物作燃料
C.图中甲烷经一氯甲烷转化成低碳烯烃的途径体现了“节能减排”思想
D.减少化石能源的使用能减少CO2的排放量
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师选择题专练 NA的应用练习卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值。下列叙述正确的是( )
A.2.24 L CH4气体中含有的电子数为NA
B.25 ℃时,1.0 L pH=13的Ba(OH)2溶液中含有的OH-数目为0.2NA
C.0.1NA个氯气分子溶于水形成1 L溶液,所得溶液中c(Cl-)=0.1 mol/L
D.1 mol CH3COONa和少量CH3COOH溶于水形成的中性溶液中,CH3COO-数目为NA
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师选择题专练 NA的应用练习卷(解析版) 题型:选择题
NA表示阿伏加德罗常数的值。下列说法正确的是( )
A.常温下,5.6 g Fe投入足量浓硝酸中,转移电子数目为0.3NA
B.1 L 1 mol/L Na2CO3溶液中含有C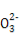 数目为NA
数目为NA
C.标准状况下,2.24 L CO和CO2混合气体中含有的碳原子数目为0.1NA
D.标准状况下,11.2 L CH3CH2OH中含有的分子数目为0.5NA
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师综合题专练 物质性质综合应用练习卷(解析版) 题型:填空题
实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·7H2O),主要工艺流程如下。
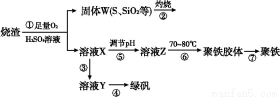
(1)将过程②产生的气体通入下列溶液中,溶液会褪色的是 。
A.品红溶液 B.紫色石蕊试液
C.酸性KMnO4溶液 D.溴水
(2)过程①中,FeS、O2和H2SO4反应的化学方程式为 。
(3)过程③中需加入的物质是 。
(4)过程④中,蒸发结晶时需使用的仪器除酒精灯、三脚架外,还需要 。
(5)过程⑤调节pH可选用下列试剂中的 (填序号)。
A.稀硫酸 B.CaCO3 C.NaOH溶液
(6)过程⑥中,将溶液Z加热到70~80 ℃,目的是 。
(7)实验室为测量所得到的聚铁样品中铁元素的质量分数,进行下列实验。①用分析天平称取2.700 0 g样品;②将样品溶于足量的盐酸后,加入过量的BaCl2溶液;③过滤、洗涤、干燥,称重得固体质量为3.495 0 g。若该聚铁的主要成分为[Fe(OH)(SO4)]n,则该聚铁样品中铁元素的质量分数为 。(假设杂质中不含铁元素和硫元素)
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师综合题专练 有机合成与推断练习卷(解析版) 题型:填空题
绿原酸是一种新型高效的酚型天然抗氧化剂,在食品行业有着广泛的用途,在某些食品中可取代或部分取代目前常用的人工合成的抗氧化剂。
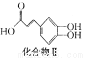
绿原酸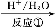
 +
+
(1)在反应①中,绿原酸与水按1∶1发生反应,则绿原酸的分子式为 ,反应①反应类型为 。
(2)1 mol化合物Ⅰ与足量金属钠反应生成标准状况下氢气体积为 。
(3)写出化合物Ⅱ与浓溴水反应的化学反应方程式: 。
(4)1 mol化合物Ⅱ与足量的试剂X反应得到化合物Ⅲ( ),则试剂X是 。
),则试剂X是 。
(5)化合物Ⅳ有如下特点:①与化合物Ⅱ互为同分异构体;②遇FeCl3溶液显色;③1 mol化合物Ⅳ与足量银氨溶液反应生成4 mol Ag;④苯环上的一卤代物只有一种。写出化合物Ⅳ的一种可能的结构简式: 。
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师综合题专练 化学反应原理练习卷(解析版) 题型:填空题
煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
(1)已知在25 ℃、101 kPa时,C(s)、H2(g)和CO(g)燃烧的热化学方程式分别为:
C(s)+O2(g)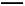 CO2(g) ΔH1=-393.5 kJ/mol;
CO2(g) ΔH1=-393.5 kJ/mol;
H2(g)+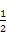 O2(g)
O2(g)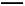 H2O(g) ΔH2=-241.8 kJ/mol;
H2O(g) ΔH2=-241.8 kJ/mol;
CO(g)+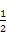 O2(g)
O2(g) CO2(g) ΔH3=-283.0 kJ/mol;
CO2(g) ΔH3=-283.0 kJ/mol;
①则C(s)+H2O(g) CO(g)+H2(g) ΔH= ,该反应平衡常数的表达式为K= ;升高温度,则K值 (填“变大”、“变小”或“不变”)。
CO(g)+H2(g) ΔH= ,该反应平衡常数的表达式为K= ;升高温度,则K值 (填“变大”、“变小”或“不变”)。
②如果①反应在容积不变的密闭容器中进行,当反应达到平衡时 (填编号)。
a.v正(CO)∶v逆(H2)=1∶1
b.碳的质量保持不变
c.v正(CO)=v逆(H2O)
d.容器中的压强不变
③在容积不变的密闭容器中进行①反应,可以使c(CO)增大的是 。
a.升高温度
b.充入He(g),使体系压强增大
c.将H2(g)从体系中分离出来
d.加入催化剂
(2)将不同量的CO(g)和H2O(g)分别通入体积为2 L的恒容密闭容器中,进行反应CO(g)+H2O(g) CO2(g)+H2(g),得到如下2组数据:
CO2(g)+H2(g),得到如下2组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
H2O | CO | H2 | CO | |||
1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
①实验1中以v(CO2)表示的反应速率为 。
②向实验2的平衡混合物中再加入0.4 mol H2O(g)和0.4 mol CO2,达到新平衡时CO的转化率 (填“变大”、“变小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题8化学反应速率与化学平衡练习卷(解析版) 题型:填空题
一定温度下在体积为5 L的密闭容器中发生可逆反应。(Ⅰ)若某可逆反应的化学平衡常数表达式为:K=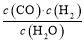
(1)写出该反应的化学方程式:
(2)能判断该反应一定达到化学平衡状态的依据是 (填选项编号)。
A.容器中气体的平均相对分子质量不随时间而变化
B.v正(H2O)=v逆(H2)
C.容器中气体的密度不随时间而变化
D.容器中总质量不随时间而变化
E.消耗n mol H2的同时消耗n mol CO
(Ⅱ)若该密闭容器中加入的是2 mol Fe(s)与1 mol H2O(g),t1秒时,H2的物质的量为0.20 mol,到第t2秒时恰好达到平衡,此时H2的物质的量为0.35 mol。
(1)t1~t2这段时间内的化学反应速率v(H2)= 。
(2)若继续加入2 mol Fe(s),则平衡 移动(填“向正反应方向”、“向逆反应方向”或“不”),继续通入1 mol H2O(g),再次达到平衡后,H2物质的量为 mol。
(3)该反应的逆反应速率随时间变化的关系如图。t1时改变了某种条件,改变的条件可能是 、 (填写2项)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com