
 [B(OH)4]-(aq)+H+(aq) K=5.7×10-10(298K)
[B(OH)4]-(aq)+H+(aq) K=5.7×10-10(298K)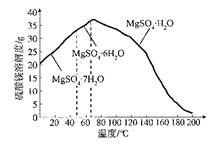
| 化学式 | 碳酸 | 醋酸 |
| 电离常数 | K1=4.4×10-7 K2=4.7×10-11 | K=1.75×10-5 |

 [B(OH)4]- (aq)+H+(aq)
[B(OH)4]- (aq)+H+(aq)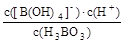 =
=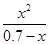 =
=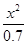 =5.7×10-10
=5.7×10-10 [B(OH)4]- (aq)+H+(aq)
[B(OH)4]- (aq)+H+(aq)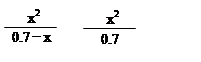 K=
K=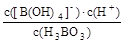 = = =5.7×10-10
= = =5.7×10-10 ,B正确;等浓度的碳酸和硼酸溶液比较,碳酸酸性强,pH值小,C错误;等浓度的碳酸钠和醋酸钠溶液比较,碳酸钠水解程度大,碱性强,所以pH大,D正确。故选BD。
,B正确;等浓度的碳酸和硼酸溶液比较,碳酸酸性强,pH值小,C错误;等浓度的碳酸钠和醋酸钠溶液比较,碳酸钠水解程度大,碱性强,所以pH大,D正确。故选BD。

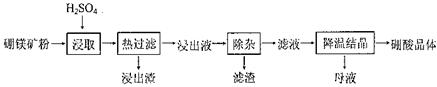
科目:高中化学 来源:不详 题型:实验题
| 温度物理溶解度 | 0 ℃ | 10 ℃ | 20 ℃ | 30 ℃ | 40 ℃ | 50 ℃ | 60 ℃ |
| FeSO4·7H2O | 15.6 | 20.5 | 26.5 | 32.9 | 40.2 | 48.6 | - |
| (NH4)2SO4 | 70.6 | 73.0 | 75.4 | 78.0 | 81.0 | - | 88.0 |
| (NH4)2SO4·FeSO4·6H2O | 12.5 | 17.2 | 21.0 | 28.1 | 33.0 | 40.0 | 44.6 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
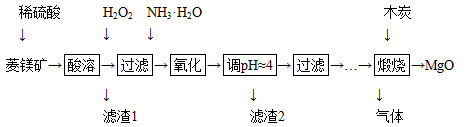
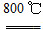 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑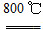 MgO+SO2↑+CO↑
MgO+SO2↑+CO↑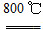 MgO+S↑+3CO↑
MgO+S↑+3CO↑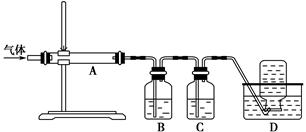
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
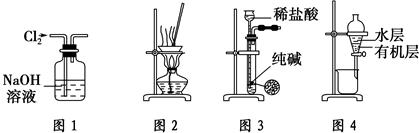
| A.用图1所示装置除去Cl2中含有的少量HCl |
| B.用图2所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体 |
| C.用图3所示装置制取少量纯净的CO2气体 |
| D.用图4所示装置分离CCl4萃取碘水后已分层的有机层和水层 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
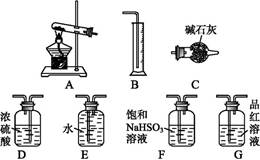
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.BaCl2 | B.HCl | C.NaOH | D.Ba(OH)2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 物质 | 杂质 | 除杂质所用试剂和方法 |
| A | KCl溶液 | I2 | CCl4,萃取分液 |
| B | CO2 | HCl | 饱和NaHCO3溶液,洗气 |
| C | CaCO3 | CaO | 盐酸,过滤 |
| D | Mg粉 | Al粉 | NaOH溶液,过滤 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
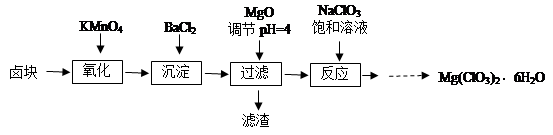
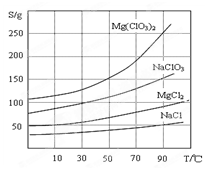
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
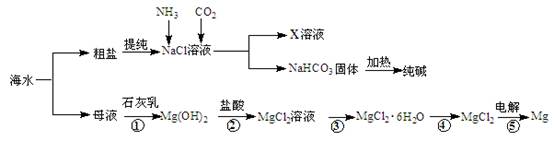
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com