
·ÖĪö £Ø1£©ĶÓėÅØĮņĖįŌŚ¼ÓČČĢõ¼žĻĀ·“Ӧɜ³ÉĮņĖįĶ”¢¶žŃõ»ÆĮņŗĶĖ®£»
£Ø2£©·“Ó¦ŗó½«ČÜŅŗĻ”ŹĶ³É500mL£¬“ÓÖŠČ”³ö25mL£¬ŌŁ¼ÓČė×ćĮæµÄNaHCO3·ŪÄ©£¬ÓַųöĘųĢå112mL£¬ĖłŅŌ500mL²Ī¼Ó·“Ó¦·Å³ö¶žŃõ»ÆĢ¼µÄĪļÖŹµÄĮæĪŖ£ŗ$\frac{112”Į1{0}^{-3}}{22.4}”Į\frac{500}{25}$=0.1mol£¬øł¾Ż¹ŲĻµŹ½£ŗH+”«CO2¼ĘĖć£»
£Ø3£©ÓÉ·“Ó¦Cu+2H2SO4£ØÅØ£©$\frac{\underline{\;\;”÷\;\;}}{\;}$CuSO4+SO2”ü+2H2O£¬Éś³É224mL¶žŃõ»ÆĮņµÄĪļÖŹµÄĮæĪŖ£ŗ0.01mol£¬ĖłŅŌ·“Ó¦ĻūŗĵÄĮņĖįµÄĪļÖŹµÄĮæĪŖ0.01mol”Į2=0.02mol£¬Ōņ4.0mLÅØĮņĖįµÄĪļÖŹµÄĮæĪŖ£ŗ0.02mol+$\frac{0.1mol}{2}$=0.07mol£¬øł¾Żc=$\frac{n}{V}$¼ĘĖćĒó½ā£®
½ā“š ½ā£ŗ£Ø1£©ĶÓėÅØĮņĖįŌŚ¼ÓČČĢõ¼žĻĀ·“Ӧɜ³ÉĮņĖįĶ”¢¶žŃõ»ÆĮņŗĶĖ®£¬·“Ó¦µÄ·½³ĢŹ½ĪŖ£ŗCu+2H2SO4£ØÅØ£©$\frac{\underline{\;\;”÷\;\;}}{\;}$CuSO4+SO2”ü+2H2O£¬¹Ź“š°øĪŖ£ŗCu+2H2SO4£ØÅØ£©$\frac{\underline{\;\;”÷\;\;}}{\;}$CuSO4+SO2”ü+2H2O£»
£Ø2£©·“Ó¦ŗó½«ČÜŅŗĻ”ŹĶ³É500mL£¬“ÓÖŠČ”³ö25mL£¬ŌŁ¼ÓČė×ćĮæµÄNaHCO3·ŪÄ©£¬ÓַųöĘųĢå112mL£¬ĖłŅŌ500mL²Ī¼Ó·“Ó¦·Å³ö¶žŃõ»ÆĢ¼µÄĪļÖŹµÄĮæĪŖ£ŗ$\frac{112”Į1{0}^{-3}}{22.4}”Į\frac{500}{25}$=0.1mol£¬ÓÉH+”«CO2£¬ĖłŅŌĒāĄė×ÓµÄĪļÖŹµÄĮæĪŖ0.1mol£¬ĖłŅŌĒāĄė×ÓµÄĪļÖŹµÄĮæÅØ¶ČŹĒ£»$\frac{0.1mol}{0.5L}$=0.2mol/L£¬¹Ź“š°øĪŖ£ŗ0.2mol/L£»
£Ø3£©ÓÉ·“Ó¦Cu+2H2SO4£ØÅØ£©$\frac{\underline{\;\;”÷\;\;}}{\;}$CuSO4+SO2”ü+2H2O£¬Éś³É224mL¶žŃõ»ÆĮņµÄĪļÖŹµÄĮæĪŖ£ŗ0.01mol£¬ĖłŅŌ·“Ó¦ĻūŗĵÄĮņĖįµÄĪļÖŹµÄĮæĪŖ0.01mol”Į2=0.02mol£¬Ōņ4.0mLÅØĮņĖįµÄĪļÖŹµÄĮæĪŖ£ŗ0.02mol+$\frac{0.1mol}{2}$=0.07mol£¬c=$\frac{n}{V}$=$\frac{0.07mol}{4.0”Į1{0}^{-3}L}$=17.4mol/L£¬¹Ź“š°øĪŖ£ŗ17.4mol/L£®
µćĘĄ ±¾Ģāæ¼²éĮĖ»Æѧ·½³ĢŹ½”¢Ļą¹Ų¼ĘĖćµÄŹéŠ“£¬ŹĒøßæ¼³£¼ūĢāŠĶ£¬ĢāÄæÄѶČÖŠµČ£¬øł¾Ż¹ŲĻµ¼ĘĖćŹĒ½āĢāµÄ¹Ų¼ü£®


 ŌĶĮæģ³µĻµĮŠ“š°ø
ŌĶĮæģ³µĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĆŽ”¢Ā锢ŃņĆ«¼°ŗĻ³ÉĻĖĪ¬ĶźČ«Č¼ÉÕ¶¼Ö»Éś³ÉCO2ŗĶH2O | |
| B£® | ¼ŅĶ„ÖŠ²»ŅĖÓĆĀĮŗĻ½šČŻĘ÷³¤ĘŚ“ę·ÅĻĢµÄŹ³Ę· | |
| C£® | Ė®“¦Ąķ³£ÓƵ½Ć÷·ÆŗĶĘÆ°×·Ū£¬µ«¶žÕßµÄ×÷ÓĆŌĄķ²»Ķ¬ | |
| D£® | »ĘŗÓČėŗ£æŚÉ³ÖŽµÄŠĪ³ÉĢåĻÖĮĖ½ŗĢå¾Ū³ĮµÄŠŌÖŹ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¶ąŃ”Ģā

| A£® | ¢Ł¢Ś | B£® | ¢Ś¢Ü | C£® | ¢Ū¢Ü | D£® | ¢Ł¢Ū |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | £ØCH3£©2=CHCH3ŗĶ£ØCH3£©2CHCH=CH2 | B£® | CH2=C£ØCH3£©2ŗĶCH3CH=CHCH3 | ||
| C£® | CH3CH2CH2COOH ŗĶCH3COOCH2CH2 | D£® | CH3CH2OHŗĶCH3OCH3 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
 £®
£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
 ŹŅĪĀĻĀ£¬ŌŚ0.2mol•L-1 Al2£ØSO4£©3ČÜŅŗÖŠ£¬ÖšµĪ¼ÓČė1.0mol•L-1 NaOHČÜŅŗ£¬ŹµŃé²āµĆČÜŅŗpHĖęNaOHČÜŅŗĢå»ż±ä»ÆĒśĻßČēĶ¼£¬ĻĀĮŠÓŠ¹ŲĖµ·ØÕżČ·µÄŹĒ£Ø””””£©
ŹŅĪĀĻĀ£¬ŌŚ0.2mol•L-1 Al2£ØSO4£©3ČÜŅŗÖŠ£¬ÖšµĪ¼ÓČė1.0mol•L-1 NaOHČÜŅŗ£¬ŹµŃé²āµĆČÜŅŗpHĖęNaOHČÜŅŗĢå»ż±ä»ÆĒśĻßČēĶ¼£¬ĻĀĮŠÓŠ¹ŲĖµ·ØÕżČ·µÄŹĒ£Ø””””£©| A£® | 0”śc¶Ī£¬·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ£ŗAl3++4OH-ØT[Al£ØOH£©4]- | |
| B£® | a-b¶Ī£¬ČÜŅŗpHŌö“ó£¬Al3+ÅØ¶Č²»±ä | |
| C£® | b-c¶Ī£¬¼ÓČėµÄOH-Ö÷ŅŖÓĆÓŚÉś³ÉAl£ØOH£©3³Įµķ | |
| D£® | dµćŹ±£¬Al£ØOH£©3³ĮµķæŖŹ¼Čܽā |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā


²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
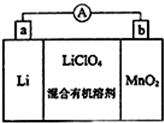 ĆĢ¼°Ęä»ÆŗĻĪļŌŚĻÖ“ś¹¤Ņµ¼°¹ś·Ą½ØÉčÖŠ¾ßÓŠŹ®·ÖÖŲŅŖµÄµŲĪ»£®
ĆĢ¼°Ęä»ÆŗĻĪļŌŚĻÖ“ś¹¤Ņµ¼°¹ś·Ą½ØÉčÖŠ¾ßÓŠŹ®·ÖÖŲŅŖµÄµŲĪ»£®²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com