
| A.K2CO3═2K++CO32- | B.KClO3═K++Cl-+3O2- |
| C.NaOH═Na++OH- | D.NaHCO3═Na++HCO3- |
科目:高中化学 来源:不详 题型:单选题
| A.CaCO3?Ca2++CO32- | B.H2CO3?2H++CO32- |
| C.NH3?H2O?NH3+H2O | D.H2SO3?H++HSO3- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:多选题
| A.次氯酸的电离方程式:HClO?H++ClO- |
| B.只有熵增加的过程才能自发进行 |
| C.HS-水解离子方程式:HS-+H2O?H3O++S2- |
| D.已知中和热为57.3kJ?mol-1,稀硫酸与氢氧化钠稀溶液反应的热化学方程式:H2SO4(aq)+2NaOH(aq)═Na2SO4(aq)+2H2O(l)△H=-114.6kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.NaHCO3=Na++HCO3- | B.NaHSO4═Na++H++SO42- |
| C.H2SO4═2H++SO42- | D.KClO3═K++Cl-+3O2- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.pH=2的盐酸中:c(H+)=c(Cl-) + c(OH-) |
| B.pH=3的醋酸中:c(H+)=3.0 mol·L-1 |
| C.pH=2的盐酸与pH=3的醋酸中溶质的物质的量浓度之比为10:1 |
| D.pH=3的醋酸与pH=11的NaOH溶液等体积混合所得溶液中:c(Na+)=c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 实验编号 | 起始浓度/(mol·L-1) | 反应后溶液的pH | |
| c(HA) | c(KOH) | ||
| ① | 0.1 | 0.1 | 9 |
| ② | x | 0.2 | 7 |
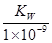 mol/L
mol/L查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 CH3COO一+H+,对于该平衡,下列叙述不正确的是 ( )
CH3COO一+H+,对于该平衡,下列叙述不正确的是 ( )| A.加入水时,平衡向正反应方向移动,溶液中n(H+)增大 |
| B.加入少量冰醋酸,平衡向正反应方向移动,溶液中c(H+)增大 |
| C.加入少量0.1 mol·L-HCl溶液,平衡向逆反应方向移动,溶液中c(H+)减小 |
| D.加入少量CH3COONa固体,平衡向逆反应方向移动,溶液中c(H+)减小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.稀醋酸溶解石灰石的离子方程式为 CaCO3+2H+=Ca2++H2O+CO2↑ |
| B.稀醋酸加水稀释后,溶液中c(CH3COO-)/c(CH3COOH)变大 |
| C.向稀醋酸中加入等浓度的NaOH溶液,导电能力变化如右图 |
| D.CH3COONH4溶液和K2SO4溶液均显中性,两溶液中水的电离程度相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com