
在25℃时,将2个铜电极插入到一定的Na2SO4饱和溶液中,通直流电电解并不断搅拌,当阴极上收集到a mol气体时,溶液中析出了b mol的结晶水合物Na2SO4·10H2O,若保持温度不变,则所剩溶液中溶质的质量分数是( )
A.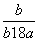 B.
B.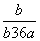 C.
C.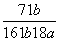 D.
D.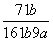
科目:高中化学 来源: 题型:
某主族元素R原子的质量数为79,已知R离子含有45个中子和36个电子,下列关于R元素的叙述错误的是( )
A. R元素属于第ⅡA族
B. R元素在周期表里处于第四周期
C. R元素最高价氧化物对应的水化物分子式为H2RO4
D. R元素气态氢化物的分子式为H2R
查看答案和解析>>
科目:高中化学 来源: 题型:
相同温度下,容积均恒为2L的甲、乙、丙3个密闭容器中发生反应:2SO2(g)+O2(g) 2SO3(g) △H=-197kJ·mol-l。实验测得起始、平衡时的有关数据如下表:
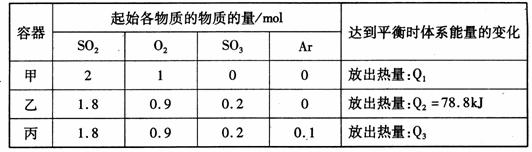
下列叙述正确的是
A.Q1>Q3>Q2 =78.8kJ
B.三个容器中反应的平衡常数均为K=2
C.甲中反应达到平衡时,若升高温度,则SO2的转化率将大于50%
D.若乙容器中的反应经tmin达到平衡,则0~tmin内,v(O2)=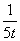 mol/(L·min)
mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
根据盖斯定律计算:已知金刚石和石墨分别在氧气中完全燃烧的热化学方程式为C(金刚石,s)+O2(g)===CO2(g) ΔH1=-395.41 kJ·mol-1,C(石墨,s)+O2(g)===CO2(g)
ΔH2=-393.51 kJ·mol-1,则金刚石转化为石墨时的热化学方程式为
________________________________________________________________________
________________________________________________________________________。
由此看来更稳定的碳的同素异形体为__________。若取金刚石和石墨的混合晶体共1 mol在O2中完全燃烧,产生热量为Q kJ,则金刚石和石墨的物质的量之比为_____________
_________(用含Q的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
用惰性电极电解M(NO3)x的水溶液,当阴极上增重a g时,在阳极上同时产生b L氧气(标准状况),从而可知M的相对原子质量为( )
A.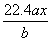 B.
B.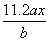 C.
C.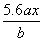 D.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
为了改善环境,还城市一个清新形象,某校同学提出下列提议:
①开发新能源,减少化石燃料的燃烧;②开发、生产无汞电池;③分类回收垃圾;④提倡使用一次性发泡塑料餐具和塑料袋;⑤提倡使用手帕,减少餐巾纸的使用;⑥提倡不使用含磷洗衣粉;⑦农业上控制化肥和农药的使用。你认为可以采纳的是 ( )。
A.①②③④⑥⑦ B.②③④⑤⑥⑦
C.①②③⑤⑥⑦ D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
高压电机、复印机工作时会产生臭氧,该气体有强氧化性。下列叙述中不正确的是 ( )。
A.臭氧和氧气是氧的同素异形体
B.臭氧可使湿润的淀粉KI试纸变蓝
C.臭氧的存在对人体有益无害
D.臭氧是很好的消毒剂和脱色剂
查看答案和解析>>
科目:高中化学 来源: 题型:
维生素C俗称抗坏血酸,常用于防治坏血病造成的血管破裂出血。为了解维生素C的化学性质,我们将6片维生素C压碎,溶于10 mL水中,然后过滤,取几亳升滤液,做下列实验:
(1)将滤液滴到蓝色石蕊试纸上试纸呈红色;再用pH试纸测得维生素C溶液的pH在1至2之间。说明维生素C具有________性。
(2)在CuSO4溶液中加入滤液并加热煮沸,发现有红色的铜析出。从氧化还原的角度说明维生素C具有________性。
(3)把滤液加热煮沸5 s~10 s,再重复上述两个实验。发现维生素C的性质与未加热时的性质一样,即在100 ℃以下不会发生分解。这说明维生素C的性质比较____________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com