
����Ŀ����.ʵ���Ҿ���Ҫ��ȡij�����岢��֤����������ʡ�
��1������װ���ʺ���β�����յ���________������ţ���
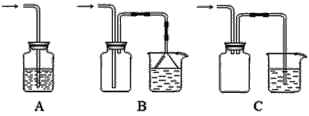
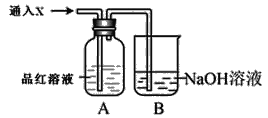
��2��������װ����ͨ������X��A��Ʒ����Һ��ɫ����X������_____�����������֣����Ҫ֤��X��SO2����,�������IJ�����______
��.ʵ������FeSO4��Һ��NaOH��Һ��Ӧ��ȡFe(OH)2��ȴ���ѿ����ȶ��İ�ɫ��������ͬѧ�����һ���µ�ʵ�鷽����������������ɰ�ɫ��������ɫ����ת���ɺ��ɫ������������������¿հף�
��1��ȡһ�������0.1mol.L-1NaOH��Һ�����ձ��У�______���ٵ��뼸��ֲ���ͣ�
��2��ѡ��װ��_______��������������������������1��������Һ���뵽װ���в���ͼʾ��װ��װ�á�
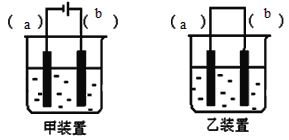
��3������ѡ���װ���ϱ����缫���Ϸֱ�Ϊ__________��________
��4��ʵ���п���______�����ȶ��İ�ɫFe(OH)2������
��5�����Ҫ������ɫ����ת��Ϊ���ɫ�����ĵ����������IJ�����________
���𰸡���.��1��BC��2�֣�
��2��SO2��Cl2��O3��ClO2�ȣ���2�֣�����ɫ�����Һ�ټ��ȣ������Һ�ָֻ��ɺ�ɫ����Xһ��ΪSO2��2�֣�
��.��1��������У�2�֣�
��2��װ�ü� ��2�֣�
��3��b-Fe ��1�֣� a-ʯī��Fe�� ��1�֣�
��4������������Һ�� ��2�֣�
��5�����缫�������� ��2�֣�
��������
����
��.��1���������Ҫ�ӷ�ֹ�����ĽǶ�ȥ�롣
��2����ʹƷ����ɫ�Ŀ������뵽SO2����ϸ��һ�»���Cl2��O3��ClO2�����Ҫ֤��ͨ����Ƕ���������Ҫ���Թ�ȡ��ɫ�����Һ���þƾ��ƽ��м��ȣ����Ƿ��ָܻ���ɫ���������ʱһ��Ҫ�в�����������
��.����Ҫע��Ŀ��Ϊ���Ʊ�Fe(OH)2���۲�����ɫ�����Թؼ������õ��Լ�Ҫ��O2��װ��Ҫ������������1����ҺҪ���������ü�����еķ������¶����ߣ�������ˮ�ǵ��ܽ���½���2������װ�õ���������������ӵ�Դ�����������Ƕ�ѡһ������������ü���ѡ��һװ�ã��������⣻�ӱ���ĽǶȣ���֪Ҫ�������������ӣ��ٺ����������ӷ�Ӧ������Ҫѡ�õ��أ�����װ�ã�b�缫Ϊ��������������������ΪFe��a�缫Ϊʯī����Ϊ�����ϲ������������ӣ�����ɫ�����������ĸ����ɹ۲쵽�����Ҫ���ɫ����ת��Ϊ���ɫ��������Ҫ�������������������в��ܼ��룬��������缫���ӣ��൱���ö��Ե缫�������������Һ�������ˮ�������Ϳɲ����ˣ�Ҳ��ʵ����ת����


 ��Կ���Ծ�ϵ�д�
��Կ���Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A��B��C��D��EΪ���ڱ�ǰ������ԭ�������������������Ԫ�ء�����A�Ļ�̬ԭ�ӵĵ���ռ��2�����Ӳ���ԭ���гɶԵ�������δ�ɶԵ�������2��������һ�ֵ�������Ȼ����Ӳ���������ʣ�C�Ļ�̬ԭ��2p�ܼ��ϵ�δ�ɶԵ�������Aԭ�ӵ���ͬ��D��Cλ��ͬһ���壬E3+ ����3d����������
(1)E��Ԫ�����ڱ���λ�ã�______________________��
(2)��A��B��C����Ԫ���У���һ�������ɴ�С��˳����___________����Ԫ�ط��Żش𣩡�
(3)Ԫ��B�ļ���̬�⻯�K������ˮ��ԭ����_____________________��
(4)Ԫ��C��D���γɵĸۻ�������ӵ����幹��Ϊ___________________��
(5)������X��Ԫ��A��C�γɵ���ԭ�ӷ��ӣ����以Ϊ�ȵ����������__________����ֻдһ����
(6)��ԭ�ӽṹ�ĽǶȽ���E3+��E2+�ȶ���ԭ��________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС������ʵ����̽�����������ʼ�ģ�ҵ��ȡƯ���������ͼװ�ý���ʵ�飺
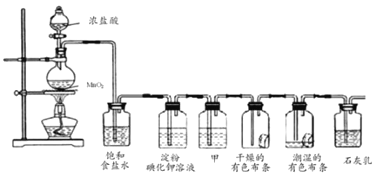
�밴Ҫ��ش��������⣺
��1��Բ����ƿ���������Ļ�ѧ����ʽ________��
��2�����۵⻯����Һ�й۲쵽��������________��
��3�����������ɫ��������ɫ��ʪ����ɫ������ɫ�������ʢ��________��
��4��![]() ��ʯ���鷴Ӧ��ȡƯ�۵Ļ�ѧ����ʽΪ________��
��ʯ���鷴Ӧ��ȡƯ�۵Ļ�ѧ����ʽΪ________��
��5�����������ַ�����ȡ���������ú��Ȼ���146g��Ũ�����������Ķ������̷�Ӧ������87g����������������Ũ���ᷴӦ������������________��
A.�ڱȢٶ� B.�ٱȢڶ� C.һ���� D.���Ƚ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ���������������Ӧ����
A | B | C | D | |
ʵ�� |
|
|
|
|
���� | ������ָ������ƫ��������Feת�Ƶ�Cu����Ƭ�̺�����ƫ | ����һ��ʱ�����Һ��ɫ��ȥ | ���ȣ�����Һ�в�����ɫ���� | ��ƿ���д�������ð����Na2SiO3��Һ����� |
���� | ��Ƭ��������Ƭ�̺�ͭƬ������ | ����������������ˮ�⣬������������ | ������ˮ������Ӧ����H2 | �ǽ����ԣ� N��C��Si |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͬ�¡�ͬѹ�£��������NH3��CH4�������壬�����й�˵��������ǣ���
A.����������Ŀ��ͬB.����֮��Ϊ16��17
C.������ԭ�����ʵ���֮��Ϊ3��4D.�ܶ�֮��Ϊ17��16
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ú��������úΪԭ�ϣ�������ѧ�ӹ�ʹúת��Ϊ���塢Һ�塢����ȼ���Լ����ֻ�����Ʒ�Ĺ�ҵ���̣���ú��������Ӧ���з������¼��ַ�Ӧ��
C��s��ʮH2O��g���TCO��g��+H2��g����H=+131kJ/mol
C��s��+O2��g���TCO2��g����H=��394kJ/mol
CO��g��+![]() O2��g���TCO2��g����H=��283kJ/mol
O2��g���TCO2��g����H=��283kJ/mol
��CO��g��+H2O��g��![]() H2��g��+CO2��g����H=____________��
H2��g��+CO2��g����H=____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ������װ���Ʊ�������Cl2�����ʣ�����˵����ȷ���� (�� ��)


A. ��ͼ�У����MnO2������Ũ����Ϳ�ȫ����Ӧ
B. ��ͼ�У�������ɫ����
C. ��ͼ�У����չ�������Ͳ����Ͳ�л��������������Һ���Ѹ������
D. ��ͼ�У�a����ɫ������ɫ��b�в���ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NA�ǰ����ӵ�������ֵ������˵����ȷ����
A.0.5 molN4������Ϊ��������ṹ�������ۼ���ĿΪ2NA
B.1 L 0.5 mol��L1 Na2S��Һ�к���������ĿС��0.5NA
C.п��Ũ���ᷴӦ��������11.2 L����״����ʱת�Ƶ�����ĿΪNA
D.14 g��ϩ�ͻ�����Ļ���ﺬ��ԭ����ĿΪ3NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ϊ36.5%��Ũ���ᣨ�ܶ�Ϊ1.16gcm��3�����Ƴ�1molL��1��ϡ���ᡣ��ʵ���ҽ���Ҫ��������220mL���Իش��������⣺
��1������ϡ����ʱ��Ӧѡ������Ϊ___������ƿ��
��2����������Ҫ___mLŨ���ᣬ����ȡʱ��ѡ��������Ͳ�е�___��
A��5mL B��10mL C��25mL D��50mL
��3�������������У������õ�����___��ѡ��ţ���
����Ͳ �ڲ����� ��ҩ�� ������ƿ ���ձ� ��̨�� �߽�ͷ�ι� ��ϸ���Լ�ƿ ���ǩֽ
��4����ʵ����������������������������ʵ���Ũ���к�Ӱ�죨����ƫ��������ƫ������������������
������ƿϴ�Ӻ�����������ˮ��___����δ����ȴ����Һע������ƿ�У�___��
��ҡ�Ⱥ���Һ���½��ټ�ˮ��___���ܶ���ʱ���ӹ۲�Һ�棬___��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com