
| A. | ①③ | B. | ①④ | C. | ②③ | D. | ③④ |
分析 ①根据v=$\frac{△c}{△t}$计算v(C),再根据速率之比等于化学计量数之比计算v(A);
②计算C的物质的量变化量,根据方程式计算转化的A的物质的量,根据转化率定义计算A的转化率;
③利用速率之比等于化学计量数之比计算v(B);
④浓度变化量之比等于化学计量数之比,据此计算B的浓度变化量,进而计算2S时B的浓度.
解答 解:①2s后测得C的浓度为0.6mol•L-1,则v(C)=$\frac{0.6mol/L}{2s}$=0.3mol/(L.min),速率之比等于化学计量数之比,故v(A)=v(C)=0.3mol/(L.min),故①正确;
②C的物质的量变化为2L×0.6mol•L-1=1.2mol,根据方程式可知转化的A的物质的量=1.2mol,故A的转化率=$\frac{1.2mol}{4mol}$×100%=30%,故②错误;
③速率之比等于化学计量数之比,故v(B)=$\frac{1}{2}$v(C)=$\frac{1}{2}$×0.3mol/(L.min)=0.15mol/(L.min),故③错误;
④浓度变化量之比等于化学计量数之比,故B的浓度变化量=$\frac{1}{2}$×0.6mol•L-1=0.3mol/L,故2S时B的浓度为$\frac{2mol}{2L}$-0.3mol/L=0.7mol/L,故④正确,
故选B.
点评 本题考查化学平衡与化学反应速率的有关计算,难度不大,侧重对基础知识的巩固,注意反应速率通常利用定义法与速率规律计算.


 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温下,钠露置在空气中易被氧气氧化为过氧化钠,因此应保存在煤油里 | |
| B. | 钠是强还原剂,它能从盐溶液中置换出金属活动顺序表中排在钠后面的金属 | |
| C. | 钠蒸气充入灯泡中制成钠灯,常用于公路照明 | |
| D. | 金属钠着火时,能用水来灭火 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③ | B. | ①③ | C. | ②④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
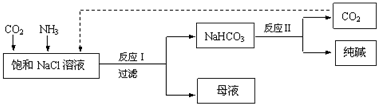
| A. | 反应Ⅰ原理为CO2+NH3+NaCl+H2O→NaHCO3↓+NH4Cl | |
| B. | 向饱和NaCl溶液中先通入足量的CO2,再通入足量的NH3 | |
| C. | 反应Ⅰ生成的沉淀,经过过滤、洗涤、煅烧可得到纯碱 | |
| D. | 往母液中通入氨气,加入细小的食盐颗粒并降温,可使氯化铵析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Y>Z>W | |
| B. | ZW2电子式为 | |
| C. | 片状Y在空气中点燃时现象不剧烈 | |
| D. | 已知XW2熔点为-107℃、沸点为12.5℃,熔融时不导电,可说明固态XW2为共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑥⑧ | B. | ②③⑤⑥⑦ | C. | ②③④⑥⑧ | D. | ①③④⑥⑦ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com