
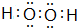
分析 短周期元素A、B、C、D的原子序数依次增大,A核外电子数等于其电子层数,则A为H元素;C为元素周期表中原子半径最小的金属元素,则C为Be;D最外层电子数是其电子层数的3倍,最外层电子数不超过8,原子只能有2个电子层,最外层电子数为6,故D为O元素;A、B同主族,B的原子序数小于Be,则B为Li.
解答 解:短周期元素A、B、C、D的原子序数依次增大,A核外电子数等于其电子层数,则A为H元素;C为元素周期表中原子半径最小的金属元素,则C为Be;D最外层电子数是其电子层数的3倍,最外层电子数不超过8,原子只能有2个电子层,最外层电子数为6,故D为O元素;A、B同主族,B的原子序数小于Be,则B为Li.
(1)电子层结构相同的离子,核电荷数越大离子半径越小,微粒半径比较:H->Li+,故答案为:>;
(2)H2O分子间除范德华力外,还能形成氢键,H2O的沸点比同主族中其他元素氢化物的沸点高,H2O2电子式 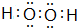 ,
,
故答案为:H2O分子间除范德华力外,还能形成氢键;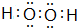 ;
;
(3)①C为Be,与Al的性质相似,Be单质能与强碱溶液反应,故答案为:能;
②B为Li,在空气中充分燃烧的产物可能是:Li3N、Li2O等,故答案为:Li3N、Li2O等.
点评 本题考查结构性质位置关系综合运用,熟练元素周期表结构与掌握元素周期律,侧重考查相似分析推理与知识迁移运用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
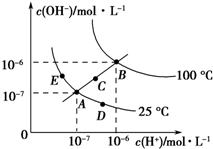 已知水的电离平衡曲线如图所示,试回答下列问题:
已知水的电离平衡曲线如图所示,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 达到平衡后,若将容器体积压缩为2 L,则正反应速率将增大,逆反应速率将减小 | |
| B. | 反应前5秒钟内,用CO表示的平均反应速率为0.04 mol•L-1•s-1 | |
| C. | 当v正(CO)=2v逆(N2)时,该反应中NO的物质的量不再改变 | |
| D. | 保持压强不变,往容器中充入1 mol He,正、逆反应速率都不改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CH2CH3 | B. | CH3-C≡C-CH3 | ||
| C. | CH3CH2CH═CH2 | D. | CH2═CH-CH═CH-CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
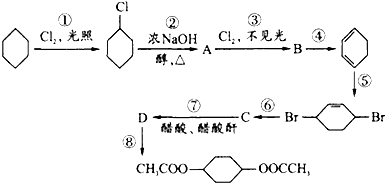
 ,C
,C .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com