
【题目】如图,直线交点处的圆圈为NaCl晶体中Na+或Cl-所处的位置。这两种离子在空间三个互相垂直的方向上都是等距离排列的。
(1)请将其中代表Na+的圆圈涂黑(不必考虑体积大小),以完成NaCl晶体结构示意图。
(2)晶体中,在每个Na+的周围与它最接近的且距离相等的Na+共有个。
(3)在NaCl晶胞中正六面体的顶点上、面上、棱上的Na+或Cl-为该晶胞与其相邻的晶胞所共有,一个晶胞中Cl-的个数等于 , 即(填计算式);Na+的个数等于 , 即(填计算式)。
(4)设NaCl的摩尔质量为Mrg·mol-1 , 食盐晶体的密度为ρg·cm-3 , 阿伏加德罗常数的值为NA。食盐晶体中两个距离最近的钠离子中心间的距离为cm。
【答案】
(1)
(答案不唯一,合理即可)
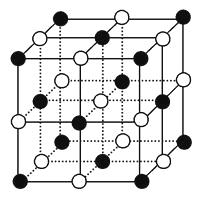
(2)12
(3)4;12× ![]() +1=4;4;8×
+1=4;4;8× ![]() +6×
+6× ![]() =4(答案不唯一,只要与第1问对应即可)
=4(答案不唯一,只要与第1问对应即可)
(4) ![]() ?
?![]()
【解析】离子晶体
(1)如图所示。 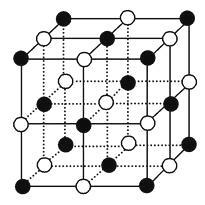 (2)从体心Na+看,与它最接近的且距离相等的Na+共有12个。(3)根据离子晶体的晶胞,求阴、阳离子个数比的方法是均摊法。由此可知,如图NaCl晶胞中,含Na+:8×
(2)从体心Na+看,与它最接近的且距离相等的Na+共有12个。(3)根据离子晶体的晶胞,求阴、阳离子个数比的方法是均摊法。由此可知,如图NaCl晶胞中,含Na+:8× ![]() +6×
+6× ![]() =4个;含Cl-:12×
=4个;含Cl-:12× ![]() +1=4个。(4)设Cl-与Na+的最近距离为acm,则两个最近的Na+间的距离为
+1=4个。(4)设Cl-与Na+的最近距离为acm,则两个最近的Na+间的距离为 ![]() acm,又:
acm,又: ![]() .NA=Mr。即a=
.NA=Mr。即a= ![]() 。所以Na+间的最近距离为:
。所以Na+间的最近距离为: ![]()
![]() 。
。
【考点精析】解答此题的关键在于理解离子晶体的相关知识,掌握离子间通过离子键结合而成的晶体叫作离子晶体.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】用98%的浓硫酸(密度为1.84g/cm3)配制100mL 1 mol/L的稀硫酸.现给出下列仪器(配制过程中可能用到):①100mL量筒 ②10mL量筒 ③50mL烧杯 ④托盘天平 ⑤100mL容量瓶 ⑥胶头滴管 ⑦玻璃棒,按使用仪器的先后顺序排列正确的是( )
A.④③⑦⑤⑥
B.②⑤⑦⑥
C.①③⑤⑥⑦
D.②⑥③⑦⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是元素周期表前四周期中的常见元素,其相关信息如下表:
元素 | 相关信息 |
X | X的基态原子L层电子数是K层电子数的2倍 |
Y | 价电子排布式为:nsnnpn+2 |
Z | Z存在质量数为23,中子数为12的核素 |
W | W有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
(1)W位于元素周期表第周期第族,其基态原子最外层有个电子。
(2)X的电负性比Y的(填“大”或“小”);X和Y的气态氢化物中,较稳定的是(写化学式)。
(3)写出Z2Y2与XY2反应的化学方程式,并标出电子转移的方向和数目:。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X的某价态离子Xn+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体结构如图所示。下列说法中错误的是( )
A.Xn+的核外电子数为19
B.该晶体中阳离子与阴离子个数比为3:1
C.Xn+中n=1
D.晶体中每个Xn+周围有2个等距离且最近的N3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年,中国药学家屠呦呦获得诺贝尔生理学或医学奖,其突出贡献是创制新型抗疟药青蒿素和双氢青蒿素.已知青蒿素的结构如图所示,有关青蒿素的说法,不正确的是( ) 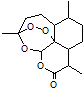
A.分子式为C15H22O5
B.能够发生水解反应
C.每个分子中含有4个六元环
D.青蒿素能够治疗疟疾可能与结构中存在过氧键基团有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有四种不同堆积方式的金属晶体的晶胞如图所示,有关说法正确的是( )
A.①为简单立方堆积,②为六方最密堆积,③为体心立方堆积,④为面心立方最密堆积
B.每个晶胞含有的原子数分别为:①1个,②2个,③2个,④4个
C.晶胞中原子的配位数分别为:①6,②8,③8,④12
D.空间利用率的大小关系为:①<②<③<④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方法中,不能用于实验室制取氨的是( )
A.在烧瓶中将熟石灰和氯化铵混合,加水调成泥状后加热
B.加热试管中的氯化铵固体
C.将烧瓶中的浓氨水加热
D.将分液漏斗中的浓氨水滴入装有生石灰的烧瓶中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com