
| 化学键 | H-H | O=O | H-O |
| 键能kJ•mol-1 | 436 | 496 | 463 |
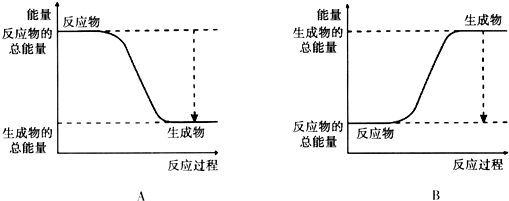
分析 (1)2H2+O2═2H2O反应是放热反应,反应物能量高于生成物分析;
(2)断裂化学键吸收能量,形成化学键释放能量,△H=反应物中键能之和-生成物中键能之和;
(3)根据热化学方程式中焓变和方程式系数之间的关系以及热化学方程式的书写方法来回答;
(4)H元素的化合价升高,则氢气在负极失去电子,发生氧化反应,反应中消耗2molH2转移4mol电子,以此解答.
解答 解:(1)2H2+O2═2H2O反应是放热反应,反应物能量高于生成物,分析图象由图可知,A中反应物的总能量大于生成物的总能量,为放热反应,
故答案为:A;
(2)断裂2molH2中的化学键吸收2×436kJ热量,断裂1molO2中的化学键吸收496kJ热量,共吸收2×436+496=1368kJ热量,形成4molH-O键释放4×463kJ=1852kJ热量,2mol H2在氧气中燃烧生成气态水的反应热△H=反应物中键能之和-生成物中键能之和=1368-1852kJ/mol=-484kJ/mol,即2mol H2在氧气中燃烧生成气态水放出的热量为484kJ,
故答案为:484kJ;
(3)1克氢气完全燃烧生成液态水放出QKJ的热量,则4克氢气完全燃烧生成液态水放出4QKJ的热量,氢气燃烧生成液态水的热化学反应方程式为2H2 (g)+O2(g)=2H2O(l)△H=-4QKJ/mol,
故答案为:2H2 (g)+O2(g)=2H2O(l)△H=-4QKJ/mol;
(4)H元素的化合价升高,则氢气在负极失去电子,发生氧化反应,反应中消耗2molH2转移4mol电子,则电路中每转移0.2mol电子,标准状况下消耗H2的体积是0.1mol×22.4L/mol=2.24L,故答案为:2.24.
点评 本题考查较综合,涉及化学反应速率的影响因素、化学键及反应中能量变化、原电池等,为高频考点,侧重化学反应原理的考查,有利于基础知识的夯实,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Li、Be、B原子最外层电子数逐渐增多 | |
| B. | P、S、Cl最高正价依次升高 | |
| C. | N、O、F得电子能力逐渐减弱 | |
| D. | Li、Na、K、Rb的金属性依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA | |
| B. | 1mol CH3+(碳正离子)中含有电子数为10NA | |
| C. | 室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA | |
| D. | 1mol乙烷分子含有8NA个共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 投料比$\frac{n{H}_{2}p}{nC{O}_{2}p}$ | 500K | 600K | 700K |
| 1.5 | 45% | 33% | 20% |
| x | a | b | c |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
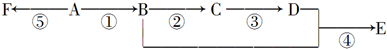
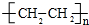 .
.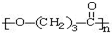 ),它可代替F,以减少“白色污染”. 聚丁内酯可用环丁内酯开环聚合而成,其工业生产方法和降解原理如下:
),它可代替F,以减少“白色污染”. 聚丁内酯可用环丁内酯开环聚合而成,其工业生产方法和降解原理如下: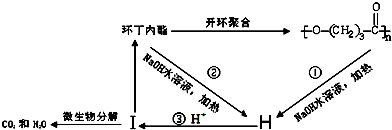
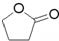 .
. .
.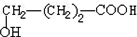 +9O2$\stackrel{微生物}{→}$8CO2↑+8H2O.
+9O2$\stackrel{微生物}{→}$8CO2↑+8H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
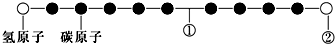
| A. | ①处的化学键是碳碳双键 | |
| B. | ②处的原子可能是氯原子 | |
| C. | 该分子中的原子不可能均在同一直线上 | |
| D. | 该分子不存在链状同分异构体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com