
 ,上述反应涉及的第二周期元素中第一电离能由大到小的顺序为F>O>C(用元素符号表示).
,上述反应涉及的第二周期元素中第一电离能由大到小的顺序为F>O>C(用元素符号表示).
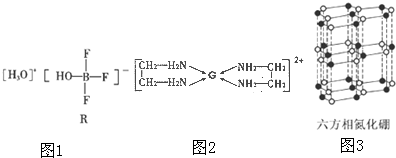
分析 (1)P是15号元素,最外层有5个电子,根据电子排布规律书写电子的排布图,题中反应涉及的第二周期元素有C、O、F,根据元素的非金属性可比较出第一电离能由大到小;
(2)上述物质中,P4中的磷原子周围有三对共用电子对和一对孤电子对,SiF4中硅原子周围有四对共用电子对,都是sp3杂化,SiF4中硅原子周围有四对共用电子对,没有孤电子对,据此判断分子构型;根据上述反应可知,反应中有二氧化硅为原子晶体,而生成物中没有原子晶体;
(3)碳、硅同一主族,CF4、SiF4都是分子晶体,结构相似,结构相似分子晶体,相对分子质量越大,其沸点越高,原子半径越大,越难形成π键;
(4)根据图1可知,分子中每个原子最外层均达到8电子稳定结构,则空心球为硫原子,实心球为磷原子,据此确定化合物的分子式,根据干冰晶胞的结构可知,每个二氧化碳分子周围距离最近的二氧化碳分子有12个;
(5)根据晶胞的结构图可知,晶胞中含有的碳原子数为4,硅原子数为$8×\frac{1}{8}+6×\frac{1}{2}$=4,根据$\frac{\frac{4×(12+28)}{{N}_{A}}}{(apm)^{3}}$可计算出阿伏加德罗常数.
解答 解:(1)P是15号元素,最外层有5个电子,即价层有5个电子,所以价层电子的排布图为 ,上述元素中,位于第二周期的元素为C、O、F,同周期随原子序数增大,元素第一电离能呈增大趋势,注意ⅡA、ⅤA族元素第一电离能高于同周期相邻元素,故第一电离能F>O>C,
,上述元素中,位于第二周期的元素为C、O、F,同周期随原子序数增大,元素第一电离能呈增大趋势,注意ⅡA、ⅤA族元素第一电离能高于同周期相邻元素,故第一电离能F>O>C,
故答案为: ;F>O>C;
;F>O>C;
(2)上述物质中,P4中的磷原子周围有三对共用电子对和一对孤电子对,SiF4中硅原子周围有四对共用电子对,都是sp3杂化,SiF4中硅原子周围有四对共用电子对,没有孤电子对,所以分子构型为正四面体,根据上述反应可知,反应中有二氧化硅为原子晶体,而生成物中没有原子晶体,所以消失的晶体类型为原子晶体,
故答案为:P4、SiF4;正四面体;原子晶体;
(3)碳、硅同一主族,CF4、SiF4都是分子晶体,结构相似,SiF4的相对分子质量大于CF4,SiF4分子间作用力大于CF4,所以SiF4沸点高,硅原子半径比碳原子半径大,所以硅比碳难形成π键,
故答案为:CF4、SiF4都是分子晶体,结构相似,SiF4分子间作用力大于CF4;硅原子半径比碳原子半径大;
(4)根据图1可知,分子中每个原子最外层均达到8电子稳定结构,则空心球为硫原子,实心球为磷原子,所以该化合物的分子式为P4S3,根据干冰晶胞的结构可知,每个二氧化碳分子周围距离最近的二氧化碳分子有12个,所以晶体中每个分子的配位数是12,
故答案:P4S3;12;
(5)根据晶胞的结构图可知,晶胞中含有的碳原子数为4,硅原子数为$8×\frac{1}{8}+6×\frac{1}{2}$=4,根据$\frac{\frac{4×(12+28)}{{N}_{A}}}{(apm)^{3}}$可知,NA=$\frac{4×(12+28)}{ρ×a×1{0}^{-30}}$mol-1=$\frac{1.6×1{0}^{32}}{ρa}$mol-1,
故答案为:$\frac{1.6×1{0}^{32}}{ρa}$.
点评 本题是对物质结构与性质的考查,涉及电离能、等电子体、晶胞结构与计算、化学键、杂化方式、熔沸点高低比较等,需要学生具备扎实的基础与灵活应用能力,难度中等,注意识记中学常见晶胞结构.


科目:高中化学 来源: 题型:选择题
| A. |  的系统命名法为2,5-二甲基-4-乙基己烷 的系统命名法为2,5-二甲基-4-乙基己烷 | |
| B. | 全降解塑料( )可由单体环氧丙烷( )可由单体环氧丙烷(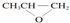 )和CO2加聚制得 )和CO2加聚制得 | |
| C. | 1mol乙酰水杨酸(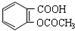 )最多可以和2molNaOH反应 )最多可以和2molNaOH反应 | |
| D. | 油脂、淀粉、蛋白质等高分子化合物都属于混合物,一定条件下均可发生水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若Q1+Q2<Q3,则反应为放热反应 | B. | 若Q1+Q2<2Q3,则反应为放热反应 | ||
| C. | 若E1+E2>E3,则反应为放热反应 | D. | 若E1+E2>E3,则反应为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2Br$→_{水}^{NaOH}$ CH3CH2OH$→_{170℃}^{浓硫酸}$ CH2=CH2$\stackrel{Br_{2}}{→}$ CH2BrCH2Br | |
| B. | CH3CH2Br $\stackrel{HBr}{→}$ CH2BrCH2Br | |
| C. | CH3CH2Br $→_{水}^{NaOH}$ CH2=CH2 CH2BrCH3$\stackrel{HBr_{2}}{→}$CH2BrCH2Br | |
| D. | CH3CH2Br $→_{醇}^{NaOH}$ CH2=CH2$\stackrel{Br_{2}}{→}$ CH2BrCH2Br |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com