
| A. | 112 mL | B. | 224 mL | C. | 336 mL | D. | 448 mL |
分析 由HNO3$\stackrel{Cu}{→}$NO、NO2$\stackrel{O_{2}}{→}$HNO3,反应前后HNO3的物质的量不变,而化合价变化的只有铜和氧气,结合电子守恒可知,Cu失去电子数目等于O2得到电子的数目,以此进行计算.
解答 解:由HNO3$\stackrel{Cu}{→}$NO、NO2$\stackrel{O_{2}}{→}$HNO3,反应前后HNO3的物质的量不变,而化合价变化的只有铜和氧气,结合电子守恒可知,Cu失去电子数目等于O2得到电子的数目,设通入的氧气的体积为x,则
$\frac{1.28g}{64g/mol}$×(2-0)=$\frac{x}{22.4L/mol}$×2×(2-0),
解得x=0.224L=224mL,
故选B.
点评 本题考查氧化还原反应的计算,为高频考点,把握发生的反应、电子守恒为解答的关键,侧重分析与计算能力的考查,注意电子守恒的应用,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
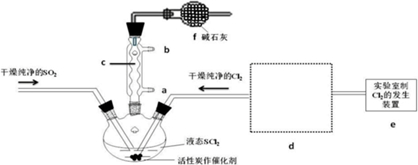
| 方案 | 甲 | 乙 | 丙 | 丁 |
| 发生装置 |  |  |  |  |
| 所选试剂 | NaHSO3固体 | 18.4mol/LH2SO4+Cu | 4mol/LHNO3+Na2SO3 | 70%H2SO4+K2SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图为实验室制取少量乙酸乙酯的装置图,下列关于该实验的叙述中,不正确的是( )
如图为实验室制取少量乙酸乙酯的装置图,下列关于该实验的叙述中,不正确的是( )| A. | 向a试管中先加入乙醇,然后边摇动试管边慢慢加入浓硫酸,再加冰醋酸 | |
| B. | 试管b中导气管下端管口不能浸入液面的原因是防止实验过程中发生倒吸现象 | |
| C. | 实验时试管b中饱和Na2CO3溶液的作用是吸收乙醇、中和乙酸及降低乙酸乙酯的溶解度便于分层 | |
| D. | 长玻璃导管只有导气的作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
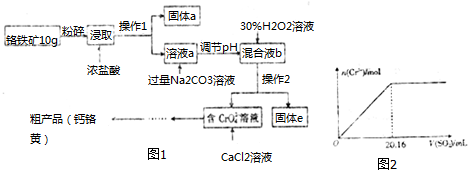
| 氢氧化物 | Ksp | 开始沉淀时的pH | 沉淀完全的pH |
| Fe(OH)3 | 2.5×10-38 | 2.3 | 3.5 |
| Fe(OH)2 | 1.0×10-15 | 7.5 | 9.5 |
| Al(OH)3 | 2.0×10-32 | 4.0 | 5.4 |
| Cr(OH)3 | 5.4×10-31 | 4.6 | 5.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
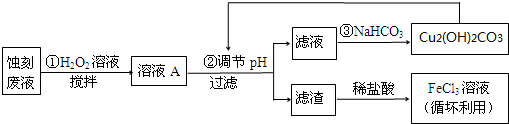
| Cu(OH)2 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 4.7 | 7.0 | 1.9 |
| 沉淀完全时 | 6.7 | 9.0 | 3.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
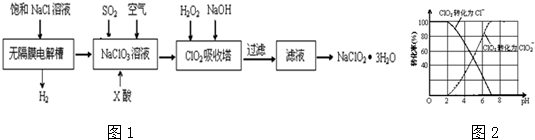
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
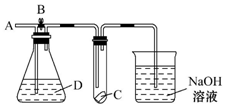 如图所示,A处通入干燥的Cl2,打开B阀后,C处的红布条逐渐褪色,关闭B阀时,C处的红布条看不到明显现象,则D瓶中装的是( )
如图所示,A处通入干燥的Cl2,打开B阀后,C处的红布条逐渐褪色,关闭B阀时,C处的红布条看不到明显现象,则D瓶中装的是( )| A. | 浓硫酸 | B. | NaOH溶液 | C. | 浓盐酸 | D. | 饱和NaCl溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com