
 等,下列化合物中存在对映异构体的是( )
等,下列化合物中存在对映异构体的是( )| A. | 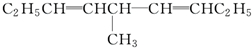 | B. | 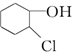 | ||
| C. | 甲酸 | D. | C6H5CH2OCH3 |
分析 根据题意知,手性碳原子必须连接4个不同的原子或原子团,具有手性碳原子的物质往往具有旋光性,存在对映异构体;通过判断有机物分子中是否存在手性碳原子即可得出答案.
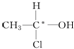
解答 解:A.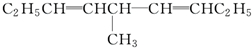 分子中,3个甲基上的碳原子所连接的四个基团有3个是一样的H,2个次甲基上的碳原子所连接的四个基团2个是一样的H,没有手性碳原子,不存在对映异构体,故A错误;
分子中,3个甲基上的碳原子所连接的四个基团有3个是一样的H,2个次甲基上的碳原子所连接的四个基团2个是一样的H,没有手性碳原子,不存在对映异构体,故A错误;
B. 分子中,和羟基相连碳及和氯原子相连碳上连着四个不同的基团,属于手性碳原子,存在对映异构体,故B正确;
分子中,和羟基相连碳及和氯原子相连碳上连着四个不同的基团,属于手性碳原子,存在对映异构体,故B正确;
C.甲酸的结构简式为HCOOH,所以甲酸分子中没有手性碳原子,不存在对映异构体,故C错误;
D.C6H5CH2OCH3中,没有手性碳原子,不存在对映异构,故D错误;
故选B.
点评 本题考查手性碳原子的判断,题目难度不大,正确判断有机物分子中是否含有手性碳原子为解答关键,明确存在手性碳原子条件:手性碳原子一定是饱和碳原子、手性碳原子所连接的四个基团要是不同的.


 百年学典课时学练测系列答案
百年学典课时学练测系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 -CH3(g)+11H2△H=kJ•mol-1.
-CH3(g)+11H2△H=kJ•mol-1.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二甲苯有三种同分异构体 | |
| B. | 二甲苯和甲苯是同系物 | |
| C. | 二甲苯分子中,所有碳原子都在同一个平面上 | |
| D. | 1mol二甲苯完全燃烧后,生成的二氧化碳和水的物质的量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚乙烯塑料的老化是由于发生了加成反应 | |
| B. | 地沟油的主要成分是油脂,其组成与汽油、煤油相同 | |
| C. | 合成纤维、人造纤维及光导纤维都属于有机高分子材料 | |
| D. | 利用粮食酿酒经过了淀粉→葡萄糖→乙醇的化学变化过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Lv位于周期表中第七周期第ⅥA族 | B. | Lv原子的次外层电子数为18 | ||
| C. | Lv为非金属元素 | D. | Lv为放射性元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 N2(g)+O2(g)=2NO(g)△H=+184kJ•mol-1.
N2(g)+O2(g)=2NO(g)△H=+184kJ•mol-1.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com