
检验某卤代烃(R-X)中的X元素,下列操作:(1)加热煮沸;(2)加入AgNO3溶液;(3)取少量该卤代烃;(4)加入足量稀硝酸酸化;(5)加入NaOH溶液;(6)冷却。正确的操作顺序是( )
A. (3) (5) (1) (6) (4) (2)
B. (3) (1) (5) (6) (2) (4)
C. (3) (2) (1) (6) (4) (5)
D. (3) (5) (1) (6) (2) (4)
科目:高中化学 来源:2015-2016学年甘肃省高一下期末理科化学试卷(解析版) 题型:选择题
把下列四种X溶液分别加入四个盛有10mL2mol/L盐酸的烧杯中,均加水稀释到50mL,此时X和盐酸缓缓地进行反应.其中反应速率最大的是( )
A.10℃,20mL3mol/L的X溶液 B.50℃20mL3mol/L的X溶液
C.50℃ 10mL4mol/L的X溶液 D.10℃10mL2mol/L的X溶液
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省宿迁市高二下学期期末化学试卷(解析版) 题型:填空题
综合利用CO2、CO对构建低碳社会有重要意义。
(1)利用H2 和CO在一定条件下发生如下反应:CO(g)+2H2(g) CH3OH(g)(放热反应)。对此反应进行如下研究:在恒温,体积为2L的密闭容器中分别充入1.2mol CO和1mol H2,10min后达到平衡,测得含有0.4mol CH3OH(g)。
CH3OH(g)(放热反应)。对此反应进行如下研究:在恒温,体积为2L的密闭容器中分别充入1.2mol CO和1mol H2,10min后达到平衡,测得含有0.4mol CH3OH(g)。
①10min后达到平衡时CO的浓度为 ;
②10min内用H2表示的平均反应速率为 ;
③若要加快CH3OH的生成速率,可采取的措施有 (填一种合理的措施)
(2)利用H2 和CO2在一定条件下可以合成乙烯:6H2+2CO2 CH2=CH2+4H2O
CH2=CH2+4H2O
①已知:4.4gCO2与H2完全转化为CH2=CH2和水(气态)共放出6.39kJ的热量,
写出该反应的热化学方程式 。
②不同温度对CO2的转化率及催化剂的催化效率的影响如图甲所示。
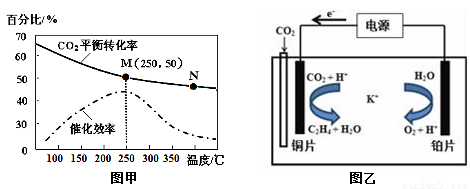
下列有关说法不正确的是 (填序号)。
A.不同条件下反应,N点的速率最大
B.温度在约250℃时,催化剂的催化效率最高
C.相同条件下,乙烯的产量M点比N高
③若在密闭容器中充入体积比为 3∶1的 H2和CO2,则图甲中M点时,产物CH2=CH2的体积分数为 。(保留两位有效数字)
(3)利用一种钾盐水溶液作电解质,CO2电催化还原为乙烯,如图乙所示。在阴极上产生乙烯的电极反应方程式为 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省宿迁市高二下学期期末化学试卷(解析版) 题型:选择题
下列物质性质的比较,不正确的是
A.稳定性:H2O>NH3 B.碱性:NaOH>Al(OH)3
C.氧化性:F2>Cl2 D.酸性:H2SO4>HClO4
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省邯郸市高二下学期期末化学试卷(解析版) 题型:实验题
为探究实验室制乙烯及乙烯和溴水的加成反应。甲同学设计了如图所示的实验装置,并进行了实验。当温度升至170℃左右时,有大量气体产生,产生的气体通入溴水中,溴水的颜色迅速褪去。甲同学认为达到了实验目的。
乙同学仔细考察了甲同学的整个实验过程,发现当温度升到100℃左右时,无色液体开始变色,到160℃左右时,混合液全呈黑色,在170℃超过后生成气体速度明显加快,生成的气体有刺激性气味。由此他推出,产生的气体中应有杂质,可能影响乙烯的检出,必须除去。据此回答下列问题:
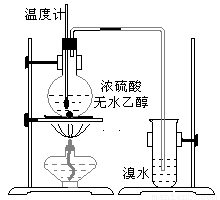
(1)写出甲同学实验中两个反应的化学方程式:____________________________________、____________________________________。
(2)乙同学观察到的黑色物质是__________,刺激性气体是__________。乙同学认为刺激性气体的存在就不能认为溴水褪色是乙烯的加成反应造成的。原因是(用化学方程表示):__________________。
(3)丙同学根据甲乙同学的分析,认为还可能有CO、CO2两种气体产生。为证明CO存在,他设计了如下过程(该过程可把实验中产生的有机产物除净):发现最后气体经点燃是蓝色火焰,确认有一氧化碳。

①设计装置a的作用是_____________________________________________
②浓溴水的作用是_________________________________________________,
稀溴水的作用是___________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省邯郸市高二下学期期末化学试卷(解析版) 题型:选择题
下列各组烃的混合物,只要总质量一定,无论按什么比例混合,完全燃烧后生成的CO2和H2O都是恒量的是 ( )
A.C2H2、C2H4 B.C2H4、C4H6
C.C3H8、C3H6 D.C6H6、C2H2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省邯郸市高二下学期期末化学试卷(解析版) 题型:选择题
2015年,中国科学家屠呦呦获得了诺贝尔医学奖,因为发现青蒿素,一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命”。如图是青蒿素的结构,则有关青蒿素的说法中不正确的是( )
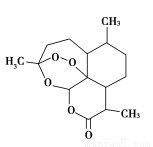
A.青蒿素分子式为C15H22O5
B.青蒿素易溶于乙醇、苯
C.青蒿素因含有—O—(醚键)而具有较强的氧化性
D.青蒿素在碱性条件下易发生水解反应
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高一下期末化学试卷(解析版) 题型:选择题
“绿色化学”对化学反应提出了“原子经济性”(原子节约)的新概念及要求,理想原子经济性反应是原料分子中的原子全部转化成所需要的产物,不产生副产物,实现零排放。下列反应类型一定符合这一要求的是
①取代反应;②加成反应;③消去反应;④水解反应;⑤加聚反应;⑥缩聚反应;⑦酯化反应
A.①④ B.②③ C.⑤⑥ D.②⑤
查看答案和解析>>
科目:高中化学 来源:2015-2016学年陕西西藏民族学院附中高二下期末化学卷(解析版) 题型:实验题
亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业.它在碱性环境中稳定存在.某同学查阅资料后设计生产NaClO2的主要流程如下。
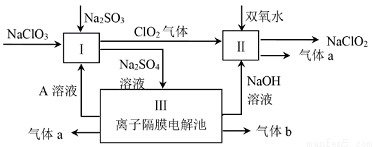
(1)Ⅰ、Ⅲ中发生反应的还原剂分别是_________、_________(填化学式).
(2)Ⅱ中反应的离子方程式是_________;
(3)装置Ⅲ中A在_________极区产生.
(4)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备:5NaClO2+4HCl=5NaCl+4ClO2↑+2H2O.
①该反应中氧化剂和还原剂的物质的量之比是_________;
②研究表明:若反应开始时盐酸浓度越大,则气体产物中Cl2的含量越大,运用氧化还原反应规律分析其原因是_________;
(5)NaClO2变质可分解为NaClO3和NaCl.取等质量变质前后的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量相同,从电子守恒的角度解释其原因是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com