
【题目】pH=2的A、B两种酸溶液各lmL,分别加水稀释到1000 mL,其溶液的pH与溶液体积(V)的关系如图所示,则下列说法正确的是( )
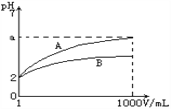
A. A、B两种酸溶液物质的量浓度一定相等
B. 稀释后A酸溶液的酸性比B酸溶液强
C. a=5时,A是强酸,B是弱酸
D. 若A、B都是弱酸,则5≥a>2
 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:
【题目】I.硫酸工业中废渣称为硫酸渣,其成分为SiO2、Fe2O3、Al2O3、MgO。某学习小组的同学设计以下方案,进行硫酸渣中金属元素的提取实验。

已知:溶液pH=3.7时,Fe3+已经沉淀完全;一水合氨饱和溶液中c(OH-)约为1×10-3 mol·L-1。
(1)写出A与氢氧化钠溶液反应的化学方程式:______________。
(2)上述流程中两次使用试剂①,推测试剂①应该是________ (填字母)。
A.氢氧化钠 B.氧化铝 C.氨水 D.水
(3)H中溶质是________。
(4)溶液D到固体E过程中需要控制溶液pH=13,如果pH过小,可能导致的后果是_______的化学式
(5)计算溶液F中的c(Mg2+)=___________________(25 ℃时,氢氧化镁的Ksp=5.6×10-12)。
II.某化学兴趣小组用下图所示装置进行电化学原理的实验探究.
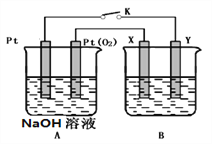
(1)A装置为乙醇燃料电池,若X、Y均是铜,电解质溶液为NaOH溶液,电池工作一段时间,X极附近生成砖红色沉淀,查阅资料得知是Cu2O,试写出该电极发生的电极反应式为___________。
(2)若B电池的电解质溶液为500 mL 1.0mol/L的NaCl溶液,X、Y皆为惰性电极,当电池工作一段时间断开电源K,Y电极有560mL(标准状况)无色气体生成(假设电极产生气体完全溢出,溶液体积不变),此时B电池溶液的pH=_______,要使该溶液恢复到原来的状态,需加入___________(填物质并注明物质的量)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,2.24L正戊烷中含有的碳原子数为0.5 NA
B. 1L0.1mol·L-1NaHCO3溶液中所含HCO3-的数目为0.1NA
C. 一定条件下,0.1mol CO与0.1mol H2O(g)充分反应,生成H2的分子数为0.1NA
D. 在反应:3FeS2+12C+8O2=Fe3O4+12CO+6S中,每生成0.6molS,转移的电子数为3.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向10 mL 0.1 mol·L-1 H2A溶液中滴加等浓度的NaOH溶液,溶液的pH与NaOH溶液的体积关系如图所示。下列叙述错误的是

A. C点溶液中含有NaHA和Na2A
B. NaHA溶液中水的电离程度比Na2A溶液中小
C. B点,c (Na+)=2[c (H2A)+c (HA)+c (A2-)]
D. D点,c (Na+)>c (A2-)>c (OH-)>c (HA-)>c (H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在四个不同的容器中进行合成氨的反应。根据下列在相同时间内测定的结果,判断生成氨的速率最快的是( )
A. v(N2)=0.05 mol·L-1·s-1 B. v(H2)=0.3 mol·L-1·min-1
C. v(N2)=0.2 mol·L-1·min-1 D. v(NH3)=0.3 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下的反应关系:
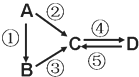
(1)若D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体。写出②反应的离子方程式_________;④反应离子方程式__________。
(2)若A是应用最广泛的金属。④反应用到A,②⑤反应均用到同一种黄绿色气体单质。写出A与水高温下反应的化学方程式_______________________。④反应的离子方程式______________。D中加入氢氧化钠的现象__________。
(3)若A是太阳能电池用的光伏材料,B常用用于制作高档光学器材,C、D为钠盐,C的水溶液俗称泡花碱,D的溶液显碱性。④反应也是通入一种引起温室效应的主要气体。写出③反应的化学方程式________________________。⑤反应用到B,反应条件为高温,则⑤的化学方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列用于解释事实的离子方程式书写正确的是
A.铁粉溶于氯化铁溶液:Fe+2Fe3+=3Fe2+
B.硫化钠溶液呈碱性:S2-+2H2O![]() H2S+2OH-
H2S+2OH-
C.氯水具有漂白性:Cl2+H2O![]() 2H++Cl-+ClO-
2H++Cl-+ClO-
D.工业上利用电解饱和食盐水制氯气:2H++2Cl-![]() H2↑+Cl2↑
H2↑+Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】84消毒液(有效成分是次氯酸钠)、漂白粉(有效成分是次氯酸钙)等物质是日常生活中常用的消毒剂,广泛应用于日常生活中。根据下列要求回答相关问题:
(1)在0.1 mol·L-1的84消毒液中滴加几滴酚酞试液,可能观察到的现象是______________,写出反应的离子方程式:______________________________。
(2)某同学测定漂白粉溶液pH的操作方法:将一小块pH试纸放在表面皿上,用玻璃棒蘸取少量待测液滴在试纸上,大约半分钟后,再与标准比色卡对照。你认为他能否达到实验目的?________(填“能”或“否”)。
(3)下列关于0.5 mol·L-1 NaClO溶液中各粒子浓度的关系式正确的是____________。
A.c(OH-)>c(H+)>c(Na+)>c(ClO-) B.c(Na+)=c(ClO-)+c(HClO)
C.c(Na+)>c(ClO-)>c(OH-)>c(H+) D.c(Na+)+c(H+)=c(ClO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M(C25H44O8)是一种新型治疗高血压病的药物,工业上用淀粉、烃A为基本原料合成M的路线如下图所示。
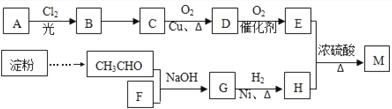
已知:I.烃A的相对分子质量为72,且分子中只有一种氢原子;B分子中核磁共振氢谱有2个峰,且面积比为9:2;35%-40%的F的水溶液被称为福尔马林。
II.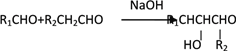
(1)A的名称为____________________(系统命名法),B的结构简式为_____________________,F的分子式为_____________。
(2)B→C的反应条件是___________________,G的官能团名称是________________________。
(3)D与银氨溶液反应的化学方程式为_________________________________________________。
(4)E有多种同分异构体,其中能发生银镜反应且属于酯类的同分异构体共有____________种,其中核磁共振氢谱有2个峰的物质结构简式为______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com