
| A. | (1)(2)(3)(5) | B. | (1)(3)(5) | C. | (2)(3)(6) | D. | (1)(3)(4)(5) |
分析 醋酸为弱酸,pH相同时,醋酸浓度大,若最后有一溶液中有锌剩余,只能是盐酸中的锌剩余.由于弱酸能通过平衡移动释放出氢离子,所以弱酸的平均反应速率更快,所用时间更短,但是反应开始时氢离子浓度相同,开始时速率相同.放出的气体一样多,所用参加反应的锌质量相同.
解答 解:①醋酸是弱酸,随反应的进行会不断电离出氢离子,所以氢离子浓度有增大的趋势,所以整个阶段的平均速率:醋酸>盐酸,所用时间乙<甲,故正确;
②开始反应速率取决于溶液中开始阶段的氢离子浓度大小,pH相同的盐酸和醋酸溶液,起始氢离子浓度一样大,所以开始反应速率:盐酸=醋酸,故错误;
③参加反应的锌的质量和生成的氢气的量有关,因为产生气体体积相同,所以参加反应的锌的质量:醋酸=盐酸,故正确;
④醋酸是弱酸,随反应的进行会不断电离出氢离子,所以氢离子浓度有增大的趋势,所以整个阶段的平均速率:醋酸>盐酸,故正确;
⑤醋酸为弱酸,pH相同时,醋酸浓度大,若最后有一溶液中有锌剩余,只能是盐酸中的锌剩余,故正确;
⑥由⑤分析可知醋酸过量,故错误.
故选D.
点评 本题考查弱酸和强酸的区别,为高频考点,侧重考查学生的分析能力,题目难度中等,本题注意弱电解质的电离平衡的移动情况.


科目:高中化学 来源: 题型:选择题
| A. | 物理 | B. | 化学 | C. | 地理 | D. | 生物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴入NaOH溶液,产生白色沉淀,则原溶液一定含有Mg2+ | |
| B. | 滴入BaCl2溶液和稀硝酸,产生白色沉淀,则原溶液一定含有SO42- | |
| C. | 滴入稀硫酸产生无色无味使澄清石灰水浑浊的气体,则原溶液一定含有CO32- | |
| D. | 滴入KSCN溶液呈无色,再通入少量Cl2后呈红色,则原溶液一定含有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
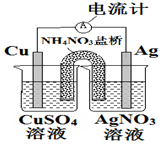
| A. | 盐桥中的NH4+离子向左侧烧杯移动 | |
| B. | 铜电极上发生的反应为Cu-2e-═Cu2+ | |
| C. | 外电路中的电子是从银电极流向铜电极 | |
| D. | 该装置能将电能转化为化学能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
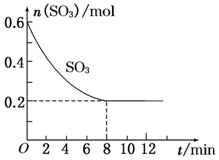 在一个2.0L的密闭容器中,发生反应2SO3(g)?2SO2(g)+O2(g)△H>0,其中SO3的变化如图所示:
在一个2.0L的密闭容器中,发生反应2SO3(g)?2SO2(g)+O2(g)△H>0,其中SO3的变化如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图是部分短周期元素的原子序数与其某种常 见化合价的关系图,若用原子序数代表所对应的元素,则下列说法中不正确的有( )
如图是部分短周期元素的原子序数与其某种常 见化合价的关系图,若用原子序数代表所对应的元素,则下列说法中不正确的有( )| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热 | B. | 增大体积 | C. | 加负催化剂 | D. | 补充 He |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol Mg与足量盐酸反应生成氢气的体积为11.2升 | |
| B. | 标准状况下,11.2L SO2所含的原子数为1.5NA | |
| C. | 8gCH4所含的氢原子数为0.5NA | |
| D. | 46g NO2和N2O4的混合物所含的分子数为1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁和稀盐酸的反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 铁与氯化铜溶液的反应:2Fe+3Cu2+═2Fe3++3Cu | |
| C. | 醋酸与NaOH溶液的反应:H++OH-═H2O | |
| D. | 碳酸镁与稀硫酸的反应:MgCO3+2H+═Mg2++H2O+CO2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com