
| A、澄清石灰水与过量的小苏打溶液反应:Ca2++OH-+HCO3-=CaCO3↓+H2O |
| B、明矾溶液中滴加Ba(OH)2溶液至SO42-恰好完全沉淀:Al3++Ba2++SO42-+3OH-=BaSO4↓+Al(OH)3↓ |
| C、200mL 2mol?L-1的FeBr2溶液中通入11.2L标准状况下的氯气:4Fe2++6Br-+5Cl2=4Fe3++3Br2+10Cl- |
| D、在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3=2FeO42-+3Cl-+H2O+4H+ |


科目:高中化学 来源: 题型:
| A、金属活动性:A>B |
| B、A极是正极,电解质溶液可以是盐酸 |
| C、B极是负极 |
| D、要判断A极与B极是正极还是负极,还需考虑电解质溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将溶液稀释到 10L |
| B、将溶液与10mL浓度为amol?L-1的NaOH溶液混合 |
| C、将溶液与10mL、pH=10的NaOH溶液混合 |
| D、往溶液中加入适量的氢氧化钠,使溶液中c(Na+)=c (CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
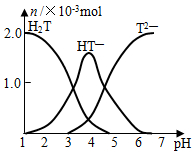 常温下,向20mL 0.1mol/L酒石酸(用H2T表示)溶液中逐滴滴加等物质的量浓度的NaOH溶液.有关微粒的物质的量与混合溶液的pH有如图关系.下列说法正确的是( )
常温下,向20mL 0.1mol/L酒石酸(用H2T表示)溶液中逐滴滴加等物质的量浓度的NaOH溶液.有关微粒的物质的量与混合溶液的pH有如图关系.下列说法正确的是( )| A、VNaOH=10mL时,溶液中存在[Na+]=2[H2T]+2[HT-]+2[T2-] |
| B、VNaOH=20mL时,溶液中存在[Na+]>[HT-]>[H+]>[H2T]>[T2-] |
| C、VNaOH=30mL时,溶液中存在[Na+]>[HT-]>[T2-]>[OH-]>[H+] |
| D、VNaOH=40mL时,溶液中存在[OH-]=[HT-]+2[H2T]+[H+] |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 试管 | 盐酸浓度 | 温度 | 锌的状态 |
| A | 0.5mol?L-1 | 30℃ | 块 状 |
| B | 0.5mol?L-1 | 30℃ | 粉末状 |
| C | 1mol?L-1 | 35℃ | 块 状 |
| D | 1mol?L-1 | 35℃ | 粉末状 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某钠盐溶液含甲电离出的阴离子,则该溶液显碱性,只能与酸反应 |
| B、乙和甲中同种元素的质量分数相等,则乙能使湿润的KI淀粉试纸变蓝 |
| C、丙中含有ⅣA族元素,则相同条件下丙比甲稳定 |
| D、若丁的分子组成符合XY3型结构,则丁分子间存在氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com