
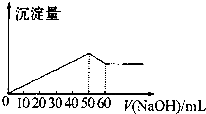
| A. | 6:1 | B. | 3:1 | C. | 3:4 | D. | 3:2 |
分析 首先发生反应Mg2++2OH-═Mg(OH)2↓、Al3++3OH-═Al(OH)3↓,然后发生反应Al(OH)3+OH-═AlO2-+2H2O,由图可知,溶解Al(OH)3消耗氢氧化钠溶液的体积为10mL,根据离子方程式Al3++3OH-═Al(OH)3↓可知,沉淀Al3+消耗的氢氧化钠溶液的体积,沉淀Mg2+、Al3+总共消耗氢氧化钠溶液50mL,计算沉淀Mg2+消耗的氢氧化钠溶液的体积,据此确定溶液中n(Mg2+):n(Al3+),最后结合硫酸镁、硫酸铝中含有的硫酸根离子的浓度之比.
解答 解:首先发生反应Mg2++2OH-═Mg(OH)2↓、Al3++3OH-═Al(OH)3↓,然后发生反应Al(OH)3+OH-═AlO2-+2H2O,由图可知,溶解Al(OH)3消耗氢氧化钠溶液的体积为10mL,根据离子方程式Al3++3OH-═Al(OH)3↓可知,沉淀Al3+消耗的氢氧化钠溶液的体积为10mL×3=30mL,沉淀Mg2+、Al3+总共消耗氢氧化钠溶液50mL,则沉淀Mg2+消耗的氢氧化钠溶液的体积为50mL-30mL=20mL,则n(Mg2+):n(Al3+)=$\frac{1}{2}$×20mL:$\frac{1}{3}$×30mL=1:1,故原来混合溶液中Al2(SO4)3和MgSO4的物质的量之比为$\frac{1}{2}$:1=1:2,
原混合溶液中Al2(S04)3与MgSO4中SO42-的物质的量浓度之比为(1×3):(2×)=3:2,
故选D.
点评 本题考查混合物的有关计算,题目难度中等,明确图象反应过程为解题关键,注意掌握镁、铝化合物的性质,试题培养了学生的分析、理解能力及化学计算能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | $\frac{x}{28}$mol-1 | B. | $\frac{x}{14}$mol-1 | C. | 14x mol-1 | D. | 28x mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4 Na2CO3 Ca(OH)2 | B. | HCl NaOH K2CO3 | ||
| C. | H2CO3 C2H5OH NaHSO4 | D. | Ba(OH)2 H3PO4 KOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠加到冷水中:Na2O2+H2O═2Na++2OH-+O2↑ | |
| B. | 过量氢氧化钠溶液与氯化铝溶液反应:Al3++3OH-═Al(OH)3↓ | |
| C. | 用氢氧化钠溶液除去铝表面的氧化膜:Al2O3+2OH-═2AlO${\;}_{2}^{-}$+H2O | |
| D. | 氢氧化钡溶液中加入稀硫酸:H++OH-═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
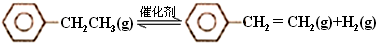
| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ•molˉ1 | 412 | 348 | 612 | 436 |
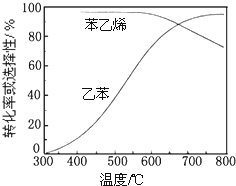
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓度分别为2 mol/L和1 mol/L的Na2CO3溶液中,C(CO32一)的比值为2:1 | |
| B. | 常温常压下,16 g 02和O3混合气体中含有NA个氧原子 | |
| C. | 46 g NO2和N204混合气体的物质的量之和大于O.5 mol,小于l mol | |
| D. | 向饱和CuS04溶液中加入1 mol CuS04固体,则析出的晶体的质量大于250 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Ba(OH)2溶液中滴加稀硫酸:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O | |
| B. | 等物质的量的MgCl2、Ba(OH)2 和 HC1溶液混合:Mg2++2OH-=Mg(OH)2↓ | |
| C. | 酸性介质中KMnO4氧化 H2O2:2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O | |
| D. | 二氧化硫通入次氯酸钠溶液:SO2+ClO-+2OH-=SO42-+Cl-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.| 操作 | 现象 |
| ①取B的溶液加入过量浓 NaOH溶液并加热 | 产生白色沉淀和无色刺激性气味气体; 过一段时间白色沉淀变为灰绿色,最终变为红褐色; |
| ②另取B的溶液, 加入过量BaCl2溶液 | 产生白色沉淀,加盐酸沉淀不溶解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com