
| A. | c(H+)=c(CH3CO0-) | |
| B. | 加水稀释时$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$增大 | |
| C. | 与pH=12的NaOH溶液等体积混合后,溶液呈酸性 | |
| D. | 加入醋酸钠固体可抑制醋酸的电离,但电离常数Ka不变 |
分析 A.根据电荷守恒分析;
B.加水稀释促进电离;
C.醋酸中氢离子浓度大于醋酸的浓度,氢氧化钠中氢氧根离子浓度等于氢氧化钠的浓度;
D.电离常数只与温度有关.
解答 解:A.pH=2的醋酸溶液中存在电荷守恒:c(H+)=c(OH-)+c(CH3CO0-),则c(H+)>c(CH3CO0-),故A错误;
B.加水稀释促进电离,溶液中CH3CO0H的物质的量减小,CH3CO0-物质的量增大,所以$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$增大,故B正确;
C.常温pH=2的醋酸溶液中醋酸的浓度大于0.01mol/L,pH=12的NaOH溶液中氢氧化钠的浓度为0.01mol/l,二者等体积混合后,醋酸有剩余,所以溶液呈酸性,故C正确;
D.加入醋酸钠固体可抑制醋酸的电离,电离平衡向逆方向移动,由于电离常数只与温度有关,所以电离常数Ka不变,故D正确.
故选A.
点评 本题综合考查弱电解质的电离平衡,题目难度中等,明确影响电离平衡的影响为解答关键,注意掌握弱电解质的电离特点,试题培养了学生的灵活应用能力.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | ①=④>③=② | B. | ①=④>③>② | C. | ①>④>③>② | D. | ④>①>③>② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
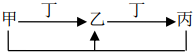 甲、乙、丙、丁四种物质中,甲、乙、丙含有相同的某种元素,它们之间有如下转化关系,则下列有关物质的推断错误的是( )
甲、乙、丙、丁四种物质中,甲、乙、丙含有相同的某种元素,它们之间有如下转化关系,则下列有关物质的推断错误的是( )| A. | 若甲为焦炭,则丁可能是O2 | |
| B. | 若甲为NaOH溶液,则丁可能是CO2 | |
| C. | 若甲为铝盐溶液,则丁可能是NaOH溶液 | |
| D. | 若甲为Fe,则丁可能是氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.5 mol/(L•s) | B. | v(B)=0.3 mol/(L•s) | C. | v(C)=0.8 mol/(L•s) | D. | v(D)=0.4 mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
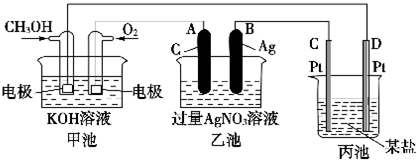
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有大量Fe3+的溶液中:Al3+、Cu2+、Cl-、SO42- | |
| B. | PH=1的溶液中:K+、Fe2+、NO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$ | |
| C. | 新鲜的空气中:SO2、NO、N2、NH3 | |
| D. | 所有氯气的集气瓶中:H2S、H2、HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L氢气所含原子数是2NA | |
| B. | 5.4g水所含的分子数为0.3NA | |
| C. | 含1mol硫酸钾的溶液中硫酸根离子数为2NA | |
| D. | 14g氮气所含有的原子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol•L-1NaHCO3溶液中,Na+数目为NA | |
| B. | 2.4gMg与足量盐酸完全反应时,失去电子数目为0.1NA | |
| C. | 等物质的量的N2和CO所含分子数、原子个数、电子总数均相同 | |
| D. | 标准状况下,11.2L的水中含有0.5个NA水分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石灰石.高岭石.石英和水晶的主要成份都是硅酸盐 | |
| B. | 浓硫酸具有吸水性.脱水性,还可以做氧化剂 | |
| C. | 过量铁粉加入CuCl2溶液中,充分反应后溶液中的阳离子主要是Fe3+ | |
| D. | 硅是应用广泛的半导体材料,常温下易与氧气、氯气、硫酸等物质反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com