
| IA | 0 | |||||||
| 1 | ① | IIA | IIIA | IVA | VA | VIA | ⅦA | |
| 2 | ⑩ | ② | ③ | ④ | ⑧ | |||
| 3 | ⑤ | ⑥ | ⑦ | ⑨ | ||||
 ,所有的燃烧反应均属于放热反应;C和O可形成化合物二氧化碳,碳原子分别与两个氧原子形成了两对共用电子对,二氧化碳的电子式为
,所有的燃烧反应均属于放热反应;C和O可形成化合物二氧化碳,碳原子分别与两个氧原子形成了两对共用电子对,二氧化碳的电子式为 ,
, ;放热;
;放热; ;
;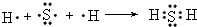 ,
,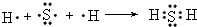 ;
;| 8.5 |
| 0.25 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 原子序数 | 电子排布式 | 在周期表中的位置 | 最高价氧化物的水化物化学式及酸碱性 | 气态氢化物的化学式 |
| 14 | ||||
| 1s22s22p63s23p5 | ||||
| 第二周期第VA主族 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com