
【题目】从石器、青铜器到铁器时代,金属的冶炼体现了人类文明的发展水平。下列有关金属冶炼的说法正确的是

A. 肯定发生的是置换反应
B. 肯定发生的是氧化还原反应
C. 只能用金属作还原剂冶炼金属
D. 如图表示了三种金属被人类开发利用的大致年限,之所以有先后,主要取决于金属在地壳中的含量多少
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列判断正确的是
A. 0.1 mol Na2O2含有的离子总数为0.4NA
B. 常温常压下,18g H2O 所含的中子数为8NA
C. 5.6 g铁与足量盐酸反应转移的电子数为0.3NA
D. 将含0.l mol FeCl3的饱和溶液制成胶体后,生成的Fe(OH)3胶粒数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将以下4份溶液分别置于如图的装置中,其它条件相同时,灯泡最亮的是
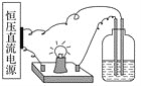
A. 100 mL 1 mol·L-1的盐酸
B. 100 mL 2 mol·L-1的蔗糖溶液
C. 100 mL 1 mol·L-1的醋酸溶液
D. 30 mL 1 mol·L-1的氯化铝溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示实验为“套管实验”,小试管内塞有沾有白色无水硫酸铜粉末的棉花球。
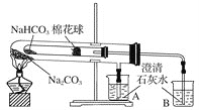
(1)点燃酒精灯加热,能观察到的实验现象是:棉花团变_____色,_____(填A或B)中的石灰水变浑浊
(2)由上述实验你能得出的结论是:Na2CO3的热稳定性_______(填大于或小于) NaHCO3
(3)写出碳酸氢钠受热分解的化学方程式______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案、现象、得出的结论均正确的是
选项 | 实验及现象 | 结论 |
A | 向SiO2固体加入过量盐酸振荡,固体不溶解 | SiO2不溶于任何酸 |
B | 用玻璃棒蘸取某样品进行焰色反应时观察到黄色火焰 | 该样品含钠元素 |
C | 向酸化的KMnO4溶液通入SO2,向反应后的溶液中加入BaCl2产生白色沉淀 | 白色沉淀为BaSO3 |
D | 将镁条点燃,迅速伸入集满CO2的集气瓶有白色固体和黑色颗粒产生 | CO2具有氧化性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有AlCl3和MgSO4混合溶液,向其中不断加入NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如图所示,求原溶液中Cl-与SO42-的物质的量之比为
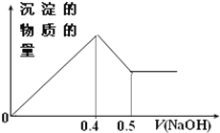
A. 3:1 B. 6:1
C. 2:3 D. 1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是一个巨大的化学资源宝库,下图是海水综合利用的部分工业流程图:
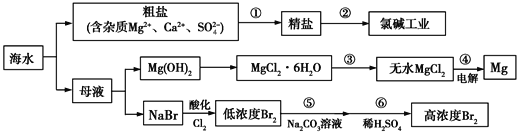
Ⅰ.在过程①中应加入的试剂分别为A.Na2CO3溶液、B.盐酸、C.BaCl2溶液、D.NaOH溶液,这4种试剂添加的合理顺序是____(填序号);过程①中须完成的实验操作分别为a.多步过滤、b.蒸发浓缩、c.冷却结晶,操作a中需要的玻璃仪器是烧杯、__________。
Ⅱ.(1)氯碱工业的反应原理是电解饱和食盐水,下列物质不可能是氯碱工业产品的是____。
A.H2 B.Cl2 C.Na2CO3 D.NaOH
(2)如图所示是离子交换膜法电解原理示意图,两极均用惰性电极材料。精制饱和食盐水进入阳极室,H+在右电极上发生____反应(填“氧化”或“还原”),所使用的离子交换膜的主要作用是____________。

(3)操作人员欲用pH试纸测定右室溶液酸碱度,其操作方法为________。
Ⅲ.过程④制取金属镁的化学方程式为MgCl2(熔融)![]() Mg+Cl2↑。简述工业上不使用电解MgO制取金属镁的原因:___。
Mg+Cl2↑。简述工业上不使用电解MgO制取金属镁的原因:___。
Ⅳ.过程⑤用纯碱溶液吸收Br2,发生的主要反应为:3Br2+3Na2CO3=5NaBr+NaBrO3+3CO2↑,则吸收1 mol Br2,转移的电子数为____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是
A. 在标准状况下,11.2L O2和22.4L NO混合并充分反应后得到的气体的分子数为NA
B. 常温下0.1mol·L-1NH4NO3溶液中的氮原子数为0.2NA
C. 1mol Na与足量O2反应,生成Na2O和Na2O2的混合物,转移的电子数为NA
D. 25℃时,1.0L pH=13的Ba(OH)2溶液中,含有的OH-数目为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),设计了如下流程:

下列说法不正确的是
A. 溶液1中的阳离子可与NH4+、HCO3-、I-、SO42-在同一溶液中大量共存
B. 向溶液2中加入3-5滴K3[Fe(CN)6](铁氰化钾)溶液,可观察到有蓝色沉淀生成
C. 向固体2中加入足量NaOH溶液,发生反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O
D. 从溶液2得到FeSO4·7H2O产品的过程中,须控制条件防止其氧化和分解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com