
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案科目:高中化学 来源: 题型:
| 滴定次数 | 待测液体积/mL | 标准盐酸体积/mL | |
| 滴定前读数/mL | 滴定后读数/mL | ||
| 第一次 | 25.00 | 0.40 | 20.38 |
| 第二次 | 25.00 | 4.00 | 24.02 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
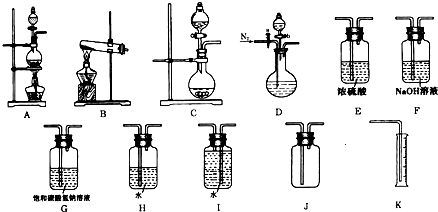
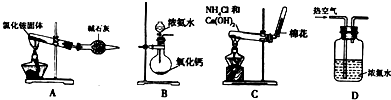
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
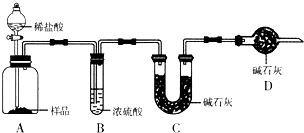 现有甲、乙、丙三个学生,欲测定某工业纯碱样品中Na2CO3的质量分数(纯碱样品中Na2CO3的质量分数为92%~96%),分别设计如下实验方案,请你帮助他们完成实验.
现有甲、乙、丙三个学生,欲测定某工业纯碱样品中Na2CO3的质量分数(纯碱样品中Na2CO3的质量分数为92%~96%),分别设计如下实验方案,请你帮助他们完成实验.
|
| 分析与计算 分组 |
计算样品中碳酸钠的质量分数 | 实验结果的评价 | 实验失败的主要原因及对结果的影响 |
| 甲 | ① |
失败 | ② |
| 乙 | ③ |
成功 | ----- |
| 丙 | ④ |
成功 | ---- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com