
【题目】设NA为阿伏加德罗常数的值,下列说法中正确的是( )
A. 36.5g HCl所含的分子数为NAB. 22.4L H2O所含的分子数为NA
C. NA个氢原子的质量为2gD. 1 mol NaCl中含0.5NA个Na+和0.5NA个Cl-
科目:高中化学 来源: 题型:
【题目】实验室中需要配制2 mol/L的NaOH溶液950 mL,配制时应选用的容量瓶的规格和称取的NaOH的质量分别是( )
A. 950 mL 76.0 g B. 500 mL 80.0 g
C. 1 000 mL 80.0 g D. 1 000 mL 76.0 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】amolFeS与bmolFeO投入VLcmol/L的HNO3溶液(过量)中,充分反应,产生气体为NO,则反应后溶液中NO3﹣的量为( )
A.62(a+b)g
B.186(a+b)g
C.(cV﹣ ![]() )mol
)mol
D.(cV﹣ ![]() )mol
)mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白磷与氧可发生如下反应:P4+5O2═P4O10 . 已知断裂下列化学键需要吸收的能量分别为:P﹣P:a kJmol﹣1、P﹣O:b kJmol﹣1、P=O:c kJmol﹣1、O=O:d kJmol﹣1 . 根据图示的分子结构和有关数据估算该反应的△H,其中正确的是( ) 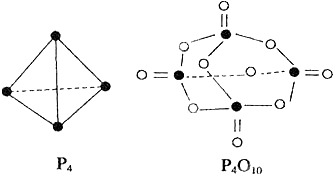
A.(6a+5d﹣4c﹣12b)kJmol﹣1
B.(4c+12b﹣6a﹣5d)kJmol﹣1
C.(4c+12b﹣4a﹣5d)kJmol﹣1
D.(4a+5d﹣4c﹣12b)kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在生产和生活中有着广泛的应用. I.氧化铁是重要工业颜料,用废铁屑制备它的流程如图: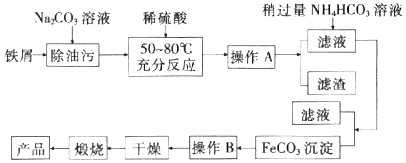
回答下列问题:
(1)操作A、B的名称分别是、;加入稍过量的NH4HCO3溶液的作用是 .
(2)写出在空气中充分加热煅烧FeCO3的化学方程式: .
(3)II.上述流程中,若煅烧不充分,最终产品中会含有少量的FeO杂质.某同学为测定产品中Fe2O3的含量,进行如下实验: a.称取样品8.00g,加入足量稀H2SO4溶解,并加水稀杯至100mL;
b.量取25.00mL待测溶液于锥形瓶中;
c.用酸化的0.01000molL﹣1KMnO4标准液滴定至终点;
d.重复操作b、c2~3次,得出消耗KMnO4溶液体积的平均值为20.00mL.
写出滴定过程中发生反应的离子方程式: .
(4)确定滴定达到终点的操作及现象为 .
(5)上述样品的质量分数为 .
(6)下列操作会导致样品中Fe2O3的质量分数的测定结果偏低的有 . a.未干澡锥形瓶 b.盛装标准液的滴定管没有用标准液润洗
c.滴定结束时仰视刻度线读数 d.量取待测液的滴定管没有润洗.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于纯净物、混合物、电解质、非电解质的组合正确的是
纯净物 | 混合物 | 电解质 | 非电解质 | |
A | HCl | 冰水混合物 | 纯碱 | 干冰 |
B | 蒸馏水 | 氨水 | 火碱[ | 二氧化硫 |
C | H2SO4 | 胆矾 | 纯碱 | 氨气 |
D | HNO3 | 食盐 | NaOH溶液 | 生石灰 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50mL 0.50molL﹣1盐酸与50mL 0.55molL﹣1NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热.试回答下列问题: 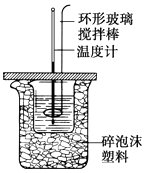
(1)大烧杯上如不盖硬纸板,求得的中和热数值将(填“偏大”、“偏小”或“无影响”).结合日常生活的实际该实验在中进行效果更好.
(2)实验中改用60m L 0.50molL﹣1盐酸与 50m L 0.55molL﹣1 NaOH溶液进行反应,与上述实验相比,所放出的热量(填“相等”或“不相等”),所求中和热(填“相等”或“不相等”),简述理由 .
(3)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会;用50m L 0.5molL﹣1 NaOH溶液进行上述实验,测得的中和热的数值会 . (均填“偏大”、“偏小”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数依次增大的A、B、C、D、E、F六种元素.其中A的基态原子有3个不同的能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为它所在周期中原子半径最大的主族元素;E和C位于同一主族,F的原子序数为29.
(1)F原子基态的外围核外电子排布式为 .
(2)在A、B、C三种元素中,第一电离能由小到大的顺序是(用元素符号回答).
(3)元素B的简单气态氢化物的沸点(高于,低于)元素A的简单气态氢化物的沸点,其主要原因是 .
(4)由A、B、C形成的离子CAB﹣与AC2互为等电子体,则CAB﹣的结构式为 .
(5)在元素A与E所形成的常见化合物中,A原子轨道的杂化类型为 .
(6)由B、C、D三种元素形成的化合物晶体的晶胞如图所示,则该化合物的化学式为 . 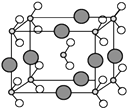
(7)FC在加热条件下容易转化为F2C,从原子结构的角度解释原因
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验验证元素周期律。
(Ⅰ)甲同学在a、b、c三只烧杯里分别加入50 mL水,再分别滴加几滴酚酞溶液,依次加入大小相近的锂、钠、钾粒,观察现象。
甲同学设计实验的目的是_____________________________________。反应最剧烈的烧杯是________(填序号)。
(Ⅱ)乙同学设计实验验证非金属元素的非金属性越强,对应的最高价含氧酸的酸性越强。他设计了右图所示装置以验证氮、碳、硅元素的非金属性强弱。

(1)已知仪器A中放一种块状固体,打开分液漏斗的活塞后,A中可观察到的现象是___________;C中可观察到的现象是_____________。
(2)仪器B盛放的试剂是______________________,其作用是_________________。
(3)分别写出A、B、C中发生反应的离子方程式______________、_______________、________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com