
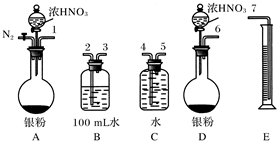
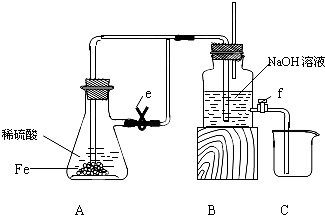
某课外活动小组设计了如下图所示的实验装置进行实验。回答下列问题:

⑴ 开始实验时弹簧夹e是打开的,A中发生反应的离子方程式为: ,
B中可以观察到的现象是 。
⑵ 数分钟后夹上弹簧夹e,B中可以观察到的现象是 。
⑶ 如果开启活塞f放掉2/3液体,B中可观察到的现象是 ,
有关反应的化学方程式是 。
(1) Fe+2H+==Fe2++H2↑;有气泡冒出 (2)有白色沉淀生成
(3) 白色沉淀先变成灰绿色, 最后变成红褐色沉淀; 4Fe(OH)2+O2+2H2O==4Fe(OH)3
【解析】
试题分析:(1)铁和稀硫酸反应生成氢气和硫酸亚铁,反应的离子方程式是Fe+2H+==Fe2++H2↑,氢气不溶于水,所以B中可以观察到的现象是有气泡冒出。
(2)由于A中的反应并没有停止,而生成的氢气的又难溶于水,所以随着反应的进行,A中的压强增大,将溶液压入B中,从而生成氢氧化亚铁白色沉淀。
(3)如果开启活塞f放掉2/3液体,则空气将进入B中。而氢氧化亚铁又极易被氧化,所以实验现象是白色沉淀先变成灰绿色,最后变成红褐色沉淀,反应的化学方程式是 4Fe(OH)2+O2+2H2O==4Fe(OH)3。
考点:考查氢氧化亚铁的制备
点评:氢氧化亚铁由于极易被氧化,所以该题的实验原理是利用生成的氢气将装置中的空气派出,从而可以很明显的看到白色的氢氧化亚铁的生成,且颜色能保持较长的时间。


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
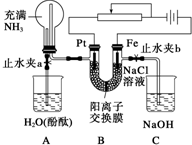 某课外活动小组设计了如图所示的装置,调节滑动变阻器,控制电流强度适中的情况下用其进行缓慢电解NaCl溶液及相关实验(此时,打开止水夹a,关闭止水夹b).由于粗心,实验并未达到预期目的,但也看到了令人很高兴的现象(阳离子交换膜只允许阳离子和水通过).
某课外活动小组设计了如图所示的装置,调节滑动变阻器,控制电流强度适中的情况下用其进行缓慢电解NaCl溶液及相关实验(此时,打开止水夹a,关闭止水夹b).由于粗心,实验并未达到预期目的,但也看到了令人很高兴的现象(阳离子交换膜只允许阳离子和水通过).查看答案和解析>>
科目:高中化学 来源: 题型:
| 2 | 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
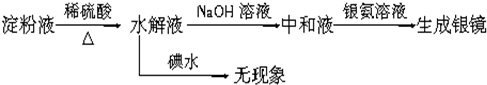
| 稀硫酸 |
| △ |
| NaOH溶液 |
| 碘水 |
| 稀硫酸 |
| △ |
| 银氨溶液 |
| 微热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com