
【题目】在已经发现的一百多种元素中,除稀有气体外,非金属元素只有十多种,但与生产生活有密切的联系。
(1)短周期中可以做半导体材料的元素的最高价氧化物与烧碱溶液反应的离子方程式是:__________;
(2)为了提高煤的利用率,常将其气化或液化,其中一种液化是将气化得到的氢气和一氧化碳在催化剂作用下转化为甲醇,写出该化学反应方程式为____________;
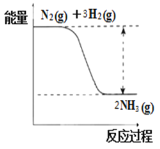
(3)氮是动植物生长不可缺少的元素,合成氨的反应对人类解决粮食问题贡献巨大,反应如下:N2(g)+3H2(g)![]() 2NH3(g)。
2NH3(g)。
①合成氨的反应中的能量变化如图所示。该反应是________反应(填“吸热”或“放热”)。
②在一定条件下,将2.5mol N2和7.5mol H2的混合气体充入体积为2L的固定闭容器中发生反应:N2(g)+ 3H2(g) ![]() 2NH3(g),5分钟末时达到平衡,测得容器内的压强是开始时的0.9倍,则5分钟内用氨气表示该反应的平均化学反应速率为:V(NH3)=____________;氢气达到平衡时的转化率是_____________(保留小数点后一位);
2NH3(g),5分钟末时达到平衡,测得容器内的压强是开始时的0.9倍,则5分钟内用氨气表示该反应的平均化学反应速率为:V(NH3)=____________;氢气达到平衡时的转化率是_____________(保留小数点后一位);
(4)美国阿波罗宇宙飞船上使用了一种新型装置,其构造如图所示:
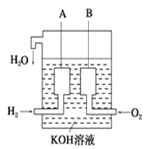
A,B两个电极均由多孔的碳块组成。该电池的正极反应式为:________________;若将上述装置中的氢气换成甲烷,其余都不改变,对应装置的负极反应方程式为_________________。
【答案】SiO2+2OH- =SiO32-+H2O CO+2H2![]() CH3OH 放热 0.1mol·L-1·min-1 20.0% O2 +4e-+2H2O=4OH- CH4–8e-+10OH-=CO32-+7H2O
CH3OH 放热 0.1mol·L-1·min-1 20.0% O2 +4e-+2H2O=4OH- CH4–8e-+10OH-=CO32-+7H2O
【解析】
(1)短周期中可以做半导体材料的元素为Si元素,Si元素的最高价氧化物为酸性氧化物SiO2;
(2)煤的液化是将气化得到的氢气和一氧化碳在催化剂作用下转化为甲醇;
(3)①反应物的总能量高于生成物的总能量的反应为放热反应;
②由题给数据建立如下三段式计算反应速率和转化率;
(4)由题给燃料电池示意图可知,通入氢气或甲烷的一极负极,通入氧气的一极为正极。
(1)短周期中可以做半导体材料的元素为Si元素,Si元素的最高价氧化物为酸性氧化物SiO2,SiO2与氢氧化钠溶液反应生成硅酸钠和水,反应的离子方程式为SiO2+2OH- =SiO32-+H2O,故答案为:SiO2+2OH- =SiO32-+H2O;
(2)煤的液化是将气化得到的氢气和一氧化碳在催化剂作用下转化为甲醇,反应的化学方程式为CO+2H2![]() CH3OH,故答案为:CO+2H2
CH3OH,故答案为:CO+2H2![]() CH3OH;
CH3OH;
(3)①由合成氨的反应中的能量变化示意图可知,反应物的总能量高于生成物的总能量,说明合成氨的反应为放热反应,故答案为:放热反应;
②设反应消耗N2的物质的量为xmol,由题给数据建立如下三段式:
N2(g)+ 3H2(g) ![]() 2NH3(g)
2NH3(g)
起(mol) 2.5 7.5 0
变(mol) x 3x 2x
平(mol)2.5—x 7.5—3x 2x
由![]() =
=![]() 可得
可得![]() =
=![]() ,解得x=0.5,则V(NH3)=
,解得x=0.5,则V(NH3)=![]() =
=![]() = 0.1mol·L-1·min-1,氢气达到平衡时的转化率为
= 0.1mol·L-1·min-1,氢气达到平衡时的转化率为![]() ×100%=
×100%=![]() ×100%=20%,故答案为:0.1mol·L-1·min-1;20%;
×100%=20%,故答案为:0.1mol·L-1·min-1;20%;
(4)由题给燃料电池示意图可知,通入氢气的一极负极,氢气在负极失电子发生氧化反应生成水,电极反应式为H2–2e-+2OH-=2H2O,通入氧气的一极为正极,氧气在正极得电子发生还原反应生成水,电极反应式为O2 +4e-+2H2O=4OH-;若将氢气换成甲烷,甲烷在负极失电子发生氧化反应生成碳酸根,电极反应式为CH4–8e-+10OH-=CO32-+7H2O,故答案为:O2 +4e-+2H2O=4OH-;CH4–8e-+10OH-=CO32-+7H2O。


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
【题目】某酯A,其分子式C6H12O2,已知
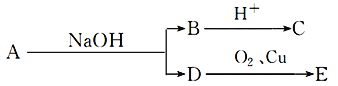
又知B、C、D、E均为有机物,D不与Na2CO3溶液反应,E不能发生银镜反应,则A结构可能有( )
A. 5种 B. 4种 C. 3种 D. 2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知充分燃烧a g乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是()
A.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);ΔH=+2b kJ/mol
B.C2H2(g)+![]() O2(g)=2CO2(g)+H2O(l);ΔH=-2b kJ/mol
O2(g)=2CO2(g)+H2O(l);ΔH=-2b kJ/mol
C.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);ΔH=-2b kJ/mol
D.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);ΔH=-b kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:有机物A的产量可以用来衡量一个国家的石油化工发展水平。现以A为主要原料合成乙酸乙酯,其合成路线如图1所示。

(1)B分子中官能团的名称是________,D中官能团的名称是_________;反应①的反应类型是__________反应。
(2)反应②的化学方程式是________________________________________,反应⑤的化学方程式是_________________________________________________。
(3)①某同学用如图2所示的实验装置制取少量乙酸乙酯.实验结束后,试管甲中上层为透明的、不溶于水的油状液体。上述实验中试管甲中试剂为___________________,其作用是(填字母)_____________。
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
D.加速酯的生成,提高其产率
②在实验室利用B和D制备乙酸乙酯的实验中,若用1mol B和1mol D充分反应,_____(能/不能)生成1mol 乙酸乙酯,原因是_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SiC、GaN、GaP、GaAs等是人工合成半导体的材料,具有高温、高频、大功率和抗辐射的应用性能而成为半导体领域研究热点。试回答下列问题:
(1)碳的基态原子L层电子轨道表达式为__,砷属于__区元素。
(2)N与氢元素可形成一种原子个数比为1:1的粒子,其式量为60,经测定该粒子中有一正四面体构型,判断该粒子中存在的化学键__。
A.配位键 B.极性共价键 C.非极性共价键 D.氢键
(3)CaC2晶体的晶胞结构与NaCl晶体的相似(如图1所示),但CaC2晶体中含有的哑铃形C22-的存在,使晶胞沿一个方向拉长。CaC2晶体中1个Ca2+周围距离最近的C22-数目为__。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C为原子序数依次递增的前四周期的元素,A的第一电离能介于镁和硫两元素之间,A单质晶体的晶胞结构如图2所示。B的价电子排布为(n+1)sn(n+1)pn+2,C位于元素周期表的ds区,其基态原子不存在不成对电子。B与C所形成化合物晶体的晶胞如图3所示。
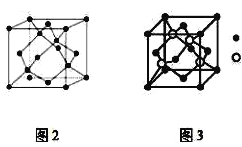
(1)A单质晶体属于__晶体(填晶体类型)。其原子杂化方式为__。
(2)B与C所形成化合物晶体的化学式__。
(3)B与C所形成化合物晶体的密度为ag/cm3,则B原子之间最近距离为__cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各图的叙述,正确的是

A. 图甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为483.6 kJ·mol-1
B. 图乙表示反应2SO2(g)+O2(g)![]() 2SO3(g)在其他条件不变时,O2的转化率随
2SO3(g)在其他条件不变时,O2的转化率随![]() 的变化关系
的变化关系
C. 图丙表示用0.100 0 mol·L-1的盐酸滴定20.00 mL 0.100 0 mol·L-1Na2CO3溶液的曲线,从A点到B点反应的离子方程式为:CO32-+2H+![]() CO2↑+H2O
CO2↑+H2O
D. 图丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液的pH随加水量的变化,则同浓度溶液的pH:NaA<NaB
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,往0.001mol·L-1的氨水中滴入几滴酚酞试液时,溶液呈现粉红色。现采取下列措施,其中能使滴有酚酞的氨水溶液颜色变浅的是
A.往溶液中滴入0.2mol·L-1的氨水
B.往溶液中加入NH4Cl晶体
C.往溶液中加入CH3COONa固体
D.往溶液中加入NaOH固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(15分)煤是重要的能源,也是生产化工产品的重要原料。试用所学知识,解答下列问题:
(1)煤的转化技术包括煤的气化技术和液化技术。煤的液化技术又分为 和
(2)在煤燃烧前需对煤进行脱硫处理。煤的某种脱硫技术的原理如下图所示:
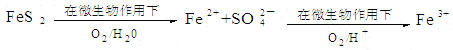
这种脱硫技术称为微生物脱硫技术。该技术的第一步反应的离子方程式为 ;第二步反应的离子方程式为 。
(3)工业煤干馏得到的产品有焦炭、 、 等。
(4)湿式石灰石—石膏法脱硫工艺是烟气脱硫技术中最成熟的一种方法。其工艺流程是:烟气经锅炉预热器出来,进入电除尘器除掉大部分粉煤灰烟尘,再经过一个专门的热交换器,然后进入吸收塔,烟气中的SO2与含有石灰石的浆液进行气液接触,通入空气后生成石膏,经脱硫的烟气,应用循环气体加热器进行再加热,进入烟囱,排入大气。
①写出湿法石灰石—石膏法脱硫所涉及的化学反应方程式:______________________。
②用石灰石浆液作SO2吸收剂而不用熟石灰吸收SO2的原因是:_________________________
③上述过程中得到的石膏,如果含氯化合物(主要来源于燃料煤)超过杂质极限值,则石膏产品性能变坏。工业上消除可溶性氯化物的方法是____________________________________ 。
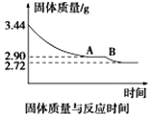
(5)某化学兴趣小组为了测定烟气脱硫所得石膏的组成(CaSO4·xH2O)即测定x值,做如下实验:将石膏加热使之脱水,加热过程中固体的质量与时间的变化关系如图所示。数据表明当固体的质量为2.72g后不再改变。①石膏的化学式为_______________。②图像中AB段对应化合物的化学式为_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com