
| 化学反应 | 催化剂 | Ea/KJ•mol-1 | k(催)/k(无) | |
| 无催化剂 | 有催化剂 | |||
| C12H22O11(蔗糖)+H2O═ C6H12O6 (葡萄糖)+C6H12O6(果糖) | 蔗糖酶 | 107 | 36 | 9.2×1011(310K) |
| 2HI═H2+I2 | 金 | 184 | 105 | 1.6×108(503K) |
| CH3CHO═CH4+CO | 碘 | 210 | 136 | 7.5×104(793K) |
| 2H2O2═2H2O+O2 | 过氧化氢酶 | 75 | 25 | 5.8×108(298K) |
科目:高中化学 来源: 题型:解答题

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -74.8kJ.mol-1 | B. | +74.8kJ.mol-1 | C. | -149.6kJ.mol-1 | D. | +149.6kJ.mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
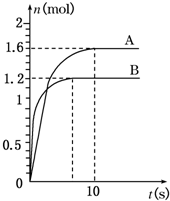
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应③中Br2 是氧化剂,溴元素被氧化 | |
| B. | 氧化性强弱顺序为:MnO4->Cl2>Fe3+>Br2 | |
| C. | 反应①中,被氧化的HCl占参加反应的HCl的5/8 | |
| D. | 溶液中可发生反应:2Fe3++2Cl-=2Fe2++Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铜溶液与铁粉反应:Cu2++Fe═Fe2++Cu | |
| B. | 碳酸钙与盐酸反应:CaCO3+2H+═H2O+CO2↑ | |
| C. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO${\;}_{4}^{2-}$═BaSO4↓ | |
| D. | 稀硫酸与铁粉反应:2Fe+6H+═2Fe3++3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  比较非金属性强弱:S>C>Si 比较非金属性强弱:S>C>Si | B. |  分离CH3COOC2H5和饱和碳酸钠溶液 分离CH3COOC2H5和饱和碳酸钠溶液 | ||
| C. |  观察纯碱的焰色反应 观察纯碱的焰色反应 | D. |  比较Na2CO3和NaHCO3的热稳定性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com