
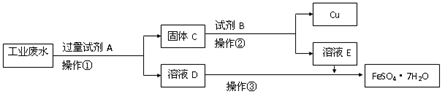
 某工厂的酸性废水中含有大量的Fe3+、Cu2+、SO42-和少量Na+.为了减少污染并变废为宝,工程师们设计了如下流程,回收铜和绿矾.
某工厂的酸性废水中含有大量的Fe3+、Cu2+、SO42-和少量Na+.为了减少污染并变废为宝,工程师们设计了如下流程,回收铜和绿矾.

 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
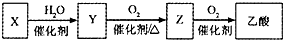 某石油化工产品X的转化关系如图,下列判断正确的是( )
某石油化工产品X的转化关系如图,下列判断正确的是( )| A、X与H2O生成Y的反应是加成反应 |
| B、1 mol Y与足量金属钠反应,能生成3 mol H2 |
| C、Z与CH3OCH3互为同分异构体 |
| D、0.1 mol?L-1乙酸溶液pH为1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、不同类的有机物可以有相同的官能团 |
| B、醚类的官能团是醚键 |
| C、所有的烷烃和芳香烃都没有官能团 |
| D、同一有机物可以含不同种官能团 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙炔 |
| B、1,3-丁二烯 |
| C、1-丙炔 |
| D、1,3-环己二烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
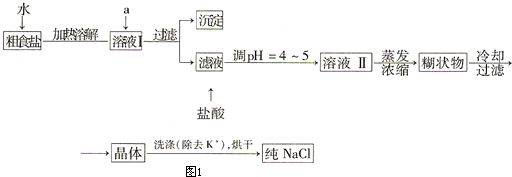
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com