
(14分)下表是元素周期表的一部分,表中所列字母分别代表某一化学元素。
|
a |
|
b |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
c |
d |
|
|
|
|
e |
f |
g |
h |
|
|
i |
|
||||||||||
|
|
|
|
|
|
|
|
|
j |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1)j是钴元素,试画出该元素的原子结构示意图 。
(2)c、d原子半径大小c d,第一电离能大小关系是c d,电负性大小关系是c d。(以上填“>”” “<”)
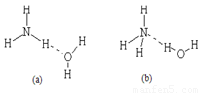
(3)已知NH3·H2O的电离方程式为NH3·H2O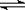 NH4++OH-,试判断NH3溶于水后,形成的NH3·H2O的合理结构是____
__ (填序号) 。
NH4++OH-,试判断NH3溶于水后,形成的NH3·H2O的合理结构是____
__ (填序号) 。
(4)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚面离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响:
①原子核对核外电子的吸引力 ②形成稳定结构的倾向
下表是一些主族元素的气态原子失去核外不同电子所需的能量(KJ·mol-):
|
|
锂 |
X |
Y |
|
失去第一个电子 |
519 |
502 |
580 |
|
失去第二个电子 |
7296 |
4570 |
1820 |
|
失去第三个电子 |
11799 |
6920 |
2750 |
|
失去第四个电子 |
|
9550 |
11600 |
表中X、Y可能分别为以上元素中的 、 (填写元素符号)元素。
(14分)(1)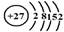 (2分) (2)>(2分) >(2分) <(2分)
(2分) (2)>(2分) >(2分) <(2分)
(3)b(2分) (4)Na(2分) Al(2分)
【解析】考查元素周期表的结构及元素周期律的应用。
(1)根据钴元素在周期表中的位置可知,钴元素的原子序数是27,所以该元素的原子结构示意图为 。
。
(2)c、d原子分别是N和O。由于同周期自左向右原子半径逐渐减小,所以碳原子半径大于氮原子半径。非金属性越强,第一电离能越大,氧元素的非金属性强于氮元素的,但由于氮元素的2p轨道电子处于半充满状态,稳定性强,所以第一电离能是氮元素大于氧元素;非金属性越强,电负性越大,所以氧元素的电负性强于氮元素的。
(3)应用氮元素的非金属性强,能和水中的氢元素形成氢键,所以形成的NH3·H2O的合理结构是b,即答案选b。
(4)X原子失去第二个电子需要的能量远高于失去第一个电子需要的能量,又因为X的第一电离能小于LI的,因此X是第IA元素,所以X是Na 。Y原子失去第四个电子需要的能量远高于失去第三个电子需要的能量,因此Y是第ⅢA元素。又因为Y的第一电离能大于钠的第一电离能,所以Y是Al。


科目:高中化学 来源: 题型:
主族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |


查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D | E | |||||||||||||
| F | G | H | |||||||||||||||
| I | J | K | |||||||||||||||
| L | |||||||||||||||||
| M | N | ||||||||||||||||
| O | |||||||||||||||||
查看答案和解析>>
科目:高中化学 来源: 题型:
| a | b | ||||||||||||||||
| c | d | ||||||||||||||||
| e | f | g | h | ||||||||||||||
| i | |||||||||||||||||
| j | |||||||||||||||||


 NH4++OH-,试判断NH3溶于水后,形成的NH3?H2O的合理结构是
NH4++OH-,试判断NH3溶于水后,形成的NH3?H2O的合理结构是 (4)1906年的诺贝尔化学奖授予为制备F2单质作出重要贡献的化学家莫瓦桑,请预测首先被用来与F2反应制备稀有气体化合物的元素是
(4)1906年的诺贝尔化学奖授予为制备F2单质作出重要贡献的化学家莫瓦桑,请预测首先被用来与F2反应制备稀有气体化合物的元素是查看答案和解析>>
科目:高中化学 来源: 题型:
| 周期 主族 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅥⅠA | 0 |
| 2 | C | N | O | F | ||||
| 3 | Na | Mg | Si | S | Cl | Ar | ||
| 4 | Ca |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com