
【题目】我国部分城市灰霾天占全年一半,引起灰霾的 PM2.5 微细粒子包含(NH4)2SO4、NH4NO3、有机颗粒物及扬尘等。通过测定灰霾中锌等重金属的含量,可知目前造成我国灰霾天气的原因主要是交通污染。
(1)Zn2+在基态时核外电子排布式为_____。
(2)NO3-的立体构型是_____。
(3)PM2.5 含有大量的有毒、有害物质,易引发二次光化学烟雾污染,光化学烟雾中含有 NOx、O3、CH2=CH—CHO、HCOOH、CH3COOONO2(PAN)等二次污染物。
①下列说法正确的是_____。
A.N2O 结构式可表示为 N=N=O
B.O3 分子呈直线形
C.CH2=CH—CHO 分子中碳原子均采用 sp2 杂化
D.相同压强下,HCOOH 沸点比 CH3OCH3高,说明前者是极性分子,后者是非极性分子
②1 mol PAN 中含σ键数目为_____(用含 NA的式子表示)。
③NO 能被 FeSO4 溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,该配合物中心离子的配位数为_____(填数字)。
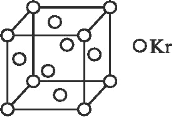
(4)测定大气中 PM2.5 的浓度方法之一是β-射线吸收法,β-射线放射源可用 85Kr,已知 Kr晶体的晶胞结构如图所示,设晶体中与每个 Kr 原子相紧邻的 Kr 原子有 m 个,晶胞中含 Kr
原子为 n 个,则m/n=___(填数字)。
(5)水分子的立体结构是_____,水分子能与很多金属离子形成配合物,其原因是在氧原子上有__________。
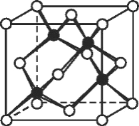
(6)冰晶胞中水分子的空间排列方式与金刚石晶胞(其晶胞结构如图,其中空心所示原子位于立方体的 顶点或面心,实心球所示原子位于立方体内)类似。每个冰晶胞平均占有_____个水分子。 冰晶胞与金刚石晶胞微粒排列方式相同的原因是_________。
【答案】1s22s22p63s23p63d10平面三角形AC0NA63V 形孤电子对8C 原子与 O 原子都为 sp3 杂化,且氢键和共价键都具有方向性和饱和性
【解析】
(1)Zn是30号元素,其原子核外有30个电子,失去两个电子生成锌离子,Zn2+基态核外有28个电子,根据构造原理书写其核外电子排布式;
(2)根据VSEPR理论和杂化轨道理论判断NO3-的空间构型;
(3)①A、N2O与CO2互为等电子体,二者形成的化学键相似,据此答题;B、O3与SO2互为等电子体,据此答题;C、CH2=CH-CHO中每个碳原子均形成两个单键和一个双键,故均为sp2杂化,据此答题;D、HCOOH分子间能形成氢键,CH3OCH3不能形成分子间氢键,据此答题;
②一个单键就是一个σ键,一个双键中含有一个σ键,一个π键;
③配体位于方括号中,由1个NO和5个H2O构成。
(4)以顶点为计算,与之相邻的最近的Kr位于三个面心上,而顶点的原子为8个立方体共有,每个面心上的Kr为两个立方体共有,故与每个Kr原子相紧邻的Kr原子有3×4=12,晶胞中含Kr原子为8×1/8+6×1/2=4,然后求出比值;
(5)根据σ键数目和孤电子对数判断分子的立体构型;水分子能与很多金属离子形成配合物,其原因是在氧原子上有孤对电子,金属离子有空轨道,能形成配位键;
(6)由图可知,水位于晶胞的顶点、面心和晶胞内,利用均摊法计算;金刚石中,C原子为sp3杂化,而冰晶胞与金刚石晶胞微粒排列方式相同,说明C原子与O原子都为sp3杂化,且氢键和共价键都具有方向性和饱和性。
(1)Zn为30号元素,所以Zn2+在基态时核外电子排布式为:1s22s22p63s23p63d10或[Ar]3d10;
因此,本题正确答案是:1s22s22p63s23p63d10;
(2)对于NO3-,根据VSEPR理论,中心N原子的配位原子数3,孤电子对数为0,则价电子对数为3+0=3,根据杂化轨道理论,中心N原子为sp2杂化,则其空间构型为平面三角形;
因此,本题正确答案是:平面三角形;
(3)①A、N2O与CO2互为等电子体,二者形成的化学键相似,故N2O结构式可表示为N=N=O,A正确;
B、O3与SO2互为等电子体,为V形分子,B错误;
C、CH2=CH-CHO中每个碳原子均形成两个单键和一个双键,故均为sp2杂化,C正确;
D、HCOOH分子间可以形成氢键,CH3OCH3分子间只有范德华力,氢键的作用强于范德华力,所以HCOOH沸点比CH3OCH3高,与分子的极性无关,D错误。
答案选AC;
②PAN中所有单键均为σ键,双键中有一个为σ键,-NO2的结构为![]() ,所以PAN(CH3COOONO2)分子中含有10个σ键,则1mo1PAN含σ键数目为10 NA(或10×6.02×1023或6.02×1022)。
,所以PAN(CH3COOONO2)分子中含有10个σ键,则1mo1PAN含σ键数目为10 NA(或10×6.02×1023或6.02×1022)。
③配体位于方括号中,由1个NO和5个H2O构成,则配位数为6。
因此,本题正确答案是:AC;10NA;6;
(4)根据均摊法,以顶点计算,与之相邻最近的Kr位于三个面心上,而顶点的原子为8个立方体共有,每个面心上的Kr为两个立方体共有,故最近的Kr为3×8/2=12,晶胞中Kr有8×1/8+6×1/2=4,两者比值为12:4=3。
因此,本题正确答案是:3;
(5)水分子中含有2个σ键,孤电子对数=![]() =2,所以水分子的立体构型为V型,水分子能与很多金属离子形成配合物,其原因是在氧原子上有孤对电子,金属离子有空轨道,能形成配位键;
=2,所以水分子的立体构型为V型,水分子能与很多金属离子形成配合物,其原因是在氧原子上有孤对电子,金属离子有空轨道,能形成配位键;
因此,本题正确答案是:V形;孤电子对;
(6)每个冰晶胞平均含有水分子数为:8×![]() +6×
+6×![]() +4=8(其中顶点为8个,面心为6个,晶胞内有4个);金刚石中,C原子为sp3杂化,而冰晶胞与金刚石晶胞微粒排列方式相同,说明C原子与O原子都为sp3杂化,且氢键和共价键都具有方向性和饱和性;
+4=8(其中顶点为8个,面心为6个,晶胞内有4个);金刚石中,C原子为sp3杂化,而冰晶胞与金刚石晶胞微粒排列方式相同,说明C原子与O原子都为sp3杂化,且氢键和共价键都具有方向性和饱和性;
因此,本题正确答案是:8 ;C原子与O原子都为sp3杂化,且氢键和共价键都具有方向性和饱和性。


科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X和气体Y各0.16 mol充入10 L恒容密闭容器中,发生反应X(g)+Y(g) 2Z(g),ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是。
A. 反应前2 min的平均速率v(Z)=2.0×10-3mol·L-1·min-1
B. 其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
C. 该温度下此反应的平衡常数K=1.44
D. 其他条件不变,再充入0.3 mol Z,平衡时X的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“废气”的综合处理与应用技术是科研人员的重要研究课题,CO、SO2、NO2是重要的大气污染气体。
(1)处理后的CO是制取新型能源二甲醚(CH3OCH3)的原料。
已知①CO(g)+H2O(g) CO2(g)+H2(g) ΔH1= -41.0 kJ/mol
②CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2= -49.0 kJ/mol
③CH3OCH3(g)+H2O(g) 2CH3OH(g) ΔH3= +23.5 kJ/mol
则反应2CO(g)+4H2(g) CH3OCH3(g)+H2O(g)的△H=________.
(2)已知973 K时,SO2与NO2反应生成SO3和NO,将混合气体经冷凝分离出的SO3可用于制备硫酸。
①973 K时,测得:NO2(g) NO(g)+ ![]() O2(g) K1=0.018;SO2(g) +
O2(g) K1=0.018;SO2(g) + ![]() O2(g) SO3(g) K2=20;则反应SO2(g)+NO2(g) SO3(g)+NO(g)的K3=________
O2(g) SO3(g) K2=20;则反应SO2(g)+NO2(g) SO3(g)+NO(g)的K3=________
②973K时,向容积为2 L的密闭容器中充入SO2、NO2 各0.2mol。平衡时SO2的转化率为______。
③恒压下,SO2的分压PSO2随温度的变化如图所示:
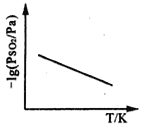
当温度升高时,SO2(g)+NO2(g) SO3(g)+NO(g)的化学平衡常数______(填“增大”或“减小”), 判断理由是______________________。
(3)用纳米铁可去除污水中的NO3-。
①纳米铁粉与水中NO3-反应的离子方程式为4Fe+NO3-+10H+=4Fe2++NH4++3H2O。研究发现,若pH偏低将会导致NO3-的去除率下降,其原因是______________________。
②相同条件下,纳米铁粉去除不同水样中的NO3-的速率有较大差异。下表中Ⅰ和Ⅱ产生差异的原因可能是________________________________________;Ⅱ中0~20min,用NO3-表示的平均反应速率为______________mol·L-l·min-1。
反应时间/min | 0 | 10 | 20 | 30 | 40 | |
Ⅰ | c(NO3-)/10-4 mol·L-1 | 8 | 3.2 | 1.6 | 0.8 | 0.64 |
Ⅱ | c(NO3-)/10-4 mol·L-1 (含少量Cu2+) | 8 | 0.48 | 0.32 | 0.32 | 0.32 |
(4)用NaOH溶液吸收SO2可得NaHSO3溶液,对NaHSO3溶液中各离子浓度的关系,下列分析不合理的是___。(已知常温下K1(H2SO3)=1.5×10-2,,K2(H2SO3)=1.02×10-7)
A.c(Na+)+c(H+)=c(HSO3-) +2c(SO32-) +c(OH-)
B.c(Na+) =c(HSO3-) +c(SO32-) +c(H2SO3)
C.c(Na+) >c(SO32-) >c(HSO3-) > (OH-)c>c(H+)
D.c(H+) +c(SO32-) =c(OH-) +c(H2SO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是
A. 化学键的断裂和形成是化学反应中能量变化的根本原因
B. 酸碱中和反应一般是放热反应
C. 等质量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多
D. 因为石墨变成金刚石吸热。所以金刚石比石墨稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有碳酸钠、碳酸氢钠、氢氧化钠、氯化铁和苯酚五种物质的溶液,它们之间有如图所示 转化关系,图中每条线两端的物质均可以发生反应, 下列判断合理的是

A. X一定是碳酸氢钠溶液 B. Y不可能为氯化铁溶液
C. Z可能为氢氧化钠溶液 D. M、N必定各为苯酚、氢氧化钠溶液中的某一种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学将铁铝合金样品溶解后取样25.00 mL,分离并测定Fe3+的浓度,实验方案设计如下:
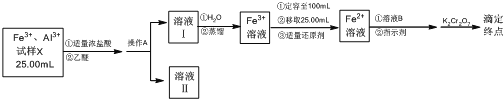
已知:乙醚[(C2H5)2O]是一种易挥发、易燃、有麻醉性的有机化合物,沸点为34.5 ℃,微溶于水。在较高的盐酸浓度下,Fe3+与HCl、乙醚形成化合物[(C2H5)2OH][FeCl4]而溶于乙醚;当盐酸浓度降低时,该化合物解离。
请回答:
(1)操作A的名称是____________。
(2)经操作A后,为判断Fe3+是否有残留,请设计实验方案___________。
(3)滴定前,加入的适量溶液B是________。
A.H2SO3H3PO4 B.H2SO4H3PO4 C.HNO3H3PO4 D.HIH3PO4
(4)滴定达到终点时,消耗0.100 0 mol·L-1 K2Cr2O7溶液6.00 mL。根据该实验数据,试样X中c(Fe3+)为________。
(5)上述测定结果存在一定的误差,为提高该滴定结果的精密度和准确度,可采取的措施是________。
A.稀释被测试样 B.减少被测试样取量
C.增加平行测定次数 D.降低滴定剂浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是一种高效消毒剂,可用如下反应制得:2NaClO3+Na2SO3+H2SO4![]() 2ClO2↑+2Na2SO4+H2O,下列说法正确的是( )
2ClO2↑+2Na2SO4+H2O,下列说法正确的是( )
A. 该反应属于复分解反应
B. NaClO3被还原,发生还原反应
C. 反应中Na2SO3作氧化剂
D. 生成6.75 g ClO2时,转移0.2 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子能大量共存,且当加入试剂后反应的离子方程式书写正确的是( )
选项 | 离子组 | 加入试剂 | 发生反应的离子方程式 |
A | Fe3+、I-、Cl- | NaOH溶液 | Fe3+ + 3OH- =Fe(OH)3↓ |
B | K+、ClO-、SO42- | 盐酸 | H++ClO- =HClO |
C | K+、OH-、Cl- | 过量SO2 | SO2+ OH-=HSO3- |
D | H+、Fe2+、 SO42- | Ba(NO3)2溶液 | SO42-+ Ba2+ =BaSO4↓ |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com