
| 纯净物 | 混合物 | 电解质 | 非电解质 | |
| A | 盐酸 | 水煤气 | 硫酸 | 干冰 |
| B | 纯碱 | Al(OH)3胶体 | 硫酸钡 | 二氧化硫 |
| C | 石墨 | 空气 | 小苏打 | 碳酸钙 |
| D | 浓硫酸 | 氨水 | 氯化钠 | 氯气 |
| A. | A | B. | B | C. | C | D. | D |
分析 纯净物是指由同种物质组成的,混合物是指由不同种物质组成的,电解质是指在水溶液里或熔化状态下能够导电的化合物,非电解质是指在水溶液里和熔化状态下都不能够导电的化合物,据此可以分析各个选项中各种的所属类别.
解答 解:A.盐酸是HCl气体的水溶液,是混合物,不是纯净物,故A错误;
B.纯碱是纯净物;Al(OH)3胶体是分散系,是混合物;硫酸钡在熔融状态下能导电的化合物,是电解质;二氧化硫在熔融状态下不导电,在水溶液中能导电和其本身无关,故是非电解质,故B正确;
C.碳酸钙在熔融状态下能导电,是电解质,故C错误;
D.非电解质是指在水溶液里和熔化状态下都不能够导电的化合物,氯气是单质,既不是电解质也不是非电解质,故D错误.
故选B.
点评 本题考查了纯净物、混合物、电解质、非电解质的概念判断及各种物质的成分掌握,难度不大,学习中注意相关基础知识的积累.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 两溶液中c(OH-):①>② | B. | 两溶液中阳离子数目:②是①的2倍 | ||
| C. | ①溶液中:c(CO32-)<c(H2CO3) | D. | ②溶液中:c(HCO3-)<c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | Na2S4O6、H2O、Na2S2O3、Au2O、NaOH | |
| B. | Na2S2O3、H2O、Na2S4O6、Au2O、NaOH | |
| C. | Na2S2O3、NaOH、Na2S4O6、Au2O、H2O | |
| D. | 当1mol Au2O3完全反应时,转移电子的物质的量为8mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 +2H2O 反应类型为:酯化反应.
+2H2O 反应类型为:酯化反应.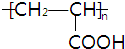 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用惰性电极电解某溶液时,若两极分别只有H2和O2生成,电解一段时间后,该溶液的浓度可能减小 | |
| B. | 电解精炼铜时,电解质溶液中铜离子浓度不变 | |
| C. | 纯锌与稀硫酸反应时,加入少量CuSO4溶液,可使反应速率加快 | |
| D. | 要使电解后的CuSO4溶液复原,可向其中加人Cu(OH)2固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ①③④⑤ | C. | ②③④⑤ | D. | ③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com