
实验室需要少量的NO气体时,常用下述方法制取:3Cu+8HNO3=3Cu(NO3)2+2NO+4H2O,现实验室有浓度为0.1 mol/L的稀硝酸400 ml,当这些硝酸全部参加反应时,求:
(1)反应生成的NO的在标准状况下的体积.
(2)反应中转移的电子的物质的量.
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
2007年徐州市区空气质量良好以上天数达到了312天,成为近年来“蓝天”最多的一年。作为产煤较多和机动车数量快速增长的地区,徐州市区空气中二氧化硫和氮氧化物含量控制的任务依然艰巨。请回答下列问题:
 (1)燃烧化石燃料排放的烟气中含有NOX和S02。含有碱的黄磷乳浊液 能够同时去除NOX和S02,这是由美国科学家研发的,命名为
(1)燃烧化石燃料排放的烟气中含有NOX和S02。含有碱的黄磷乳浊液 能够同时去除NOX和S02,这是由美国科学家研发的,命名为
PhoSNOx法。在该方法最后阶段NO2--与HSO3--反应生成(NH4)2SO4
其离子方程式为 。
(2)工业上将S02转化为SO3是在接触室(如右图)里进行的,中部是一 个热交换器,它是用导热性能好的管状材料制成。温度低的气体A 从管外流过;经上层催化反应后的热气体从管内流过,通过导热材料进行气体与气体的热交换。 中学化学实验中也有许多需要进行热交换,下列实验中需要进行热交换的(直接加热除外)是 (填字母)。
A.粗盐的提纯 B.实验室制取少量蒸馏水
C.测定中和反应过程中溶液pH的变化
D.制取乙酸乙酯 E.酚醛树脂的制取
 (3)一定条件下,N02和S02很容易发生反应生成NO和SO3(g)。现将
(3)一定条件下,N02和S02很容易发生反应生成NO和SO3(g)。现将
NO和S02的混合气体通入容积为50 ml的容器中,充满后用带有导
管的塞子密封,则再向该容器中通入O2的体积V在 mL范
围内才能保持容器内的压强不变(设气体体积均在相同条件下测定,
且不考虑NO2转化为N204)。
(4)将盛有x molNO和y mol NO2的混合气(标准状况)的试管倒扣在足量
的水中,通入O2可以使水充满试管。请在右面的坐标图中大致画出不
断通人氧气的过程中溶液的pH与V(O2)的关系曲线(设生成的硝酸均在试管内)。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省潍坊市高三第三次模拟考试理综化学试卷(解析版) 题型:实验题
CuSO4·5H2O是铜的重要化合物,有着广泛的应用。实验室用粗铜(含少量铁)制备CuSO4·5H2O的流程如下:
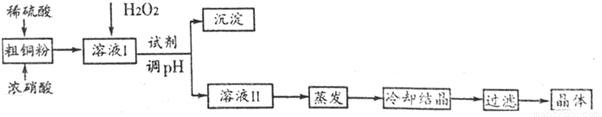
回答下列问题:
(1)实验室配制250 mL4.8 mol·L-1的稀硫酸,所需的玻璃仪器除玻璃棒、量筒、烧杯以外还需要__________________________________________________。
(2)已知不同金属离子生成氢氧化物沉淀所需的pH如下表:
|
离子 |
Fe3+ |
Cu2+ |
Fe2+ |
|
开始沉淀的pH |
2.7 |
4.4 |
7.0 |
|
沉淀完全的pH |
3.7 |
6.4 |
9.6 |
除去Fe3+,溶液的pH应控在_______________范围,调pH可选用的试剂是____________。
(3)若制得的CuSO4·5H2O中存在杂质Cu(NO3)2,进一步提纯的实验操作名称是__________。
(4)获得的CuSO4·5H2O晶体表面附着杂质离子,常用酒精洗涤的原因是____________。
用标准的BaCl2溶液测定晶体的纯度时,发现纯度大于100%(测定过程中产生的误差可忽略),其可能原因有_____________________________________________(任写一种)。
(5)实验室欲制取适量NO气体。下图中最适合的实验装置是__________(填序号),并注明装置中所需药品的名称。
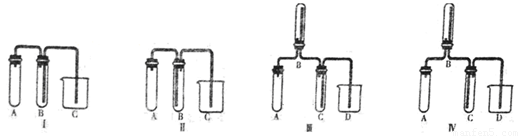
A.__________,B.__________,C.__________,D.__________。(根据选择的装置可以填满也可以不填满)
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室需要少量的NO气体时,常用下述方法制取:
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO +4H2O,现实验室有浓度为0.1mol/L的稀硝酸400ml,当这些硝酸全部参加反应时,求:
(1) 反应生成的NO的在标准状况下的体积.
(2) 反应中转移的电子的物质的量.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com