
【题目】某固体NaOH因吸收了空气中的CO2而含有杂质,现在要将该固体NaOH配制成较纯的溶液,则其主要的实验操作过程应是( )
A.溶解、加适量BaCl2溶液、过滤
B.溶解、加适量CaCl2溶液、过滤
C.溶解、加适量Ca(OH)2溶液、过滤
D.溶解、加适量盐酸、加热
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.N2的摩尔质量为28 g
B.17 g NH3的物质的量是1 mol
C.18 g H2O在标准状态下体积是22.4 L
D.将40 g NaOH溶于1 L水中,所得溶液中NaOH的物质的量浓度为1 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[选做题——物质结构与性质]
金属钛(Ti)是一种具有许多优良性能的的金属,钛和钛合金被认为是21世纪的重要金属材料。
(l) Ti(BH4)2是一种过渡元素硼氢化物储氢材料。
① Ti2+基态的电子排布式可表示为_____________________。
② BH4-的空间构型是______________________(用文字描述)。
③ 与钛同周期的所有元素的基态原子中,未成对电子数与钛相同的元素有__________种。
(2)二氧化钛(TiO2)是常用的、具有较高催化活性和稳定性的光催化剂,常用于污水处理。
①纳米TiO2催化的一个实例如下图所示。

化合物甲的分子中采取![]() 杂化方式的碳原子个数为______________, 化合物乙中采取
杂化方式的碳原子个数为______________, 化合物乙中采取![]() 杂化的原子的第一电离能由小到大的顺序为________________。
杂化的原子的第一电离能由小到大的顺序为________________。
②在 TiO2催化作用下,可将CN-氧化成CNO-,进而得到N2。与CNO-互为等电子体的分子、离子化学式分别为_________________、_______________(各写一种)。

(3)金属钛内部原子的堆积方式与铜相同,都是面心立方堆积方式,如图。若该晶胞的密度为![]()
![]() ,阿伏加德罗常数为
,阿伏加德罗常数为![]() ,则该晶胞的边长为______________cm。
,则该晶胞的边长为______________cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组设计如下实验方案。将浓硫酸与铜片反应制备SO2并进行相关实验探究,实验装置如下图所示:
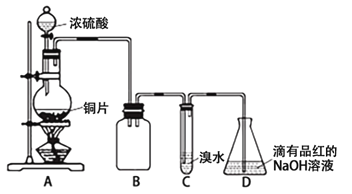
请回答下列问题:
(1)装置B的作用是 。
(2)设计装置C的目的是验证SO2的 性,装置C中发生反应的离子方程式是 。装置D中NaOH全部转化为NaHSO3的标志是 。
(3)向NaHSO3溶液中加入NaClO溶液时,反应有三种可能的情况:
I.HSO3-与ClO-恰好反应
Ⅱ.NaClO不足
Ⅲ.NaClO过量
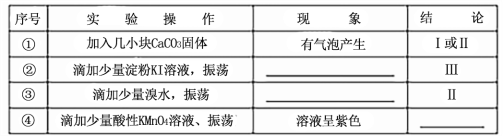
甲同学分别取上述混合溶液于试管中,通过下列实验确定该反应属于哪一种情况,请完成下表:(已知酸性:H2SO3>H2CO3>HClO)
(4)请设计简单实验证明:室温下HSO3-的电离平衡常数Ka与水解平衡常数Kb的相对大小: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组,设计了如图1所示的实验装置(部分夹持装置未画出),来做乙醇催化氧化的实验,并验证其产物。请填写下列空白:


图1 图2
(1)在A处不断鼓入空气的情况下,熄灭B处的酒精灯,反应仍能继续进行,说明乙醇的催化氧化反应是_____________反应;(填“放热”或“吸热”)
(2)装置D使用冰水进行冷却的目的是___________________;
(3)反应开始一段时间,C中观察到的现象是____________________;
(4)为检测产物,取出试管a中部分液体,加入银氨溶液,水浴加热,可观察到E试管有银镜产生,说明乙醇的催化氧化产物中存在_____________;(填官能团名称)
(5)写出E处反应的化学方程式:_______________________________。
(6)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有________________。要除去该物质,可先在混合液中加入碳酸氢钠溶液,再通过________________(填实验操作名称)即可分离主要产物。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是
A.甲硫醇(CH3SH)比甲醇(CH3OH)的熔点低的原因是甲醇分子间易形成氢键
B.N-O键的极性比C-O键的极性小
C.氨易液化与氨分子间存在氢键有关
D.H2O是一种非常稳定的化合物,这是由于氢键所致
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com