
 如图1所示,把试管放入盛有25℃的饱和澄清石灰水的烧杯中,试管开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中,试回答下列问题:
如图1所示,把试管放入盛有25℃的饱和澄清石灰水的烧杯中,试管开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中,试回答下列问题:分析 I.(1)Mg位于氢之前,能和稀盐酸反应生成氢气,该反应是放热反应,放出的热量使烧杯中溶液温度升高,氢氧化钙溶解度随着温度升高而减小;
(2)根据Mg与HCl的反应以及氢氧化钙的溶解性判断;
(3)单质、气体、沉淀等写化学式,可溶性强电解质写离子;
(4)放热反应中反应物总能量大于生成物总能量.
II.(1)能形成原电池且作原电池负极的金属易被腐蚀;
(2)在原电池中,铁易失电子发生氧化反应;
(3)铁在有水分、空气的条件下易生锈;
(4)为防止铁生锈,可以采用刷漆、涂油、连接较活泼金属、电镀等方法.
解答 解:I.(1)Mg位于氢之前,能和稀盐酸反应生成氢气,该反应是放热反应,放出的热量使烧杯中溶液温度升高,氢氧化钙溶解度随着温度升高而减小,
实验中观察到的现象是:试管中镁片逐渐溶解,产生无色气泡,烧杯外壁变热,烧杯底部析出少量白色固体;
故答案为:试管中镁片逐渐溶解,产生无色气泡,烧杯外壁变热,烧杯底部析出少量白色固体;
(2)Mg位于氢之前,能和稀盐酸反应生成氢气,该反应是放热反应,放出的热量使烧杯中溶液温度升高,氢氧化钙溶解度随着温度升高而减小,
故答案为:反应生成氢气,反应放热,氢氧化钙溶解度随着温度升高而减小;
(3)单质、气体、沉淀等写化学式,可溶性强电解质写离子,离子方程式为Mg+2H+=Mg2++H2↑,故答案为:Mg+2H+=Mg2++H2↑;
(4)放热反应中反应物总能量大于生成物总能量,该反应是放热反应,所以MgCl2溶液和H2的总能量小于镁片和盐酸的总能量,故答案为:小于;
II.(1)能形成原电池且作原电池负极的金属易被腐蚀,
A.铁、碳和溶有氧气的水能构成原电池,铁易失电子而作负极,碳作正极,作负极的铁易被腐蚀而生锈;
B.该装置中没有空气,不能形成原电池则铁不易生锈;
C.碱石灰能吸收空气中水分,则C装置中没有水,所以不能构成原电池,铁不易生锈;
故选A;
(2)A中,铁易失电子发生氧化反应而易生锈,故答案为:氧化;
(3)A易生锈,B和C不容易生锈,B中没有空气,C中没有水分,A中含有水分和空气,所以铁生锈的外部条件是:与空气、水充分接触;
故答案为:与空气、水充分接触;
(4)为防止铁生锈,可以采用隔绝空气或隔绝水的方法,如采用刷漆、涂油、连接较活泼金属、电镀等方法,故选ABC.
点评 本题考查了常见的放热反应和吸热反应以及氢氧化钙的溶解度随温度的变化关系、金属的腐蚀与防护,明确金属被腐蚀的原理是解本题关键,采用对比的方法得出金属被腐蚀的条件,从而采用合适的方法防止铁生锈,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 原子最外层电子数为2的元素一定是ⅡA元素 | |
| B. | 第三周期元素对应的离子半径从左往右依次减小 | |
| C. | 第ⅦA族元素从上到下,其氢化物的酸性逐渐减弱 | |
| D. | 第三周期的主族元素的最高正价一定等于其最外层电子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
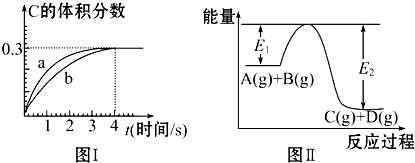
| A. | 达到平衡后,其它条件不变,降低温度,V正、V逆均减小,C的体积分数增大 | |
| B. | 该温度下,反应的平衡常数数值约为7.36 | |
| C. | 一段时间后,若气体的密度不变,则可以判断该反应已达化学平衡状态 | |
| D. | 在上述反应体系中加入催化剂,化学反应速率增大,El和E2均减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇和乙酸 | B. | 乙炔和乙醛 | C. | 乙烷和乙酸甲酯 | D. | 乙烯和乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠原子和氯原子作用生成NaCl后,其结构的稳定性增强 | |
| B. | 任何离子键在形成的过程中必定有电子的得与失 | |
| C. | 在氯化钠中,氯离子和钠离子靠静电作用结合 | |
| D. | 金属钠与氯气反应生成氯化钠后,体系能量降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢铵溶液中加入过量氢氧化钠溶液:HCO3-+OH-=CO32-+H2O | |
| B. | 氯化铝溶液中加入过量氨水:Al3++4NH3•H2O=AlO2-+4NH4++2H2O | |
| C. | 二氧化氮通入水中:3NO2+H2O=2H++2NO3-+NO | |
| D. | 氯气通入水中的反应:Cl2+H2O=2H++Cl-+ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
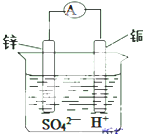 如图为某原电池示意图,请回答:
如图为某原电池示意图,请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com