
 图为北京奥运会的奖牌--“金镶玉”牌,使用了昂贵的玉石材料,其化学成分多为含水钙镁硅酸盐,如Ca2Mg5Si8O22(OH)2等.下列说法正确的是( )
图为北京奥运会的奖牌--“金镶玉”牌,使用了昂贵的玉石材料,其化学成分多为含水钙镁硅酸盐,如Ca2Mg5Si8O22(OH)2等.下列说法正确的是( )| A. | Ca2Mg5Si8O22(OH)2可用氧化物的形式表示为2CaO•5MgO•8SiO2•H2O | |
| B. | 从分类的角度看,Ca2Mg5Si8O22(OH)2为氧化物 | |
| C. | 玉石材料性质稳定,耐强酸和强碱的腐蚀 | |
| D. | Ca2Mg5Si8O22(OH)2易溶于水 |
分析 Ca2Mg5Si8O22(OH)2属于盐类,易被强酸腐蚀,不溶于水,可用氧化物的形式表示为2CaO•5MgO•8SiO2•H2O,氧化物要求只含有两种元素,切其中一种元素是氧元素.
解答 解:A.Ca2Mg5Si8O22(OH)2可用氧化物的形式表示为2CaO•5MgO•8SiO2•H2O,故A正确;
B.氧化物要求只含有两种元素,切其中一种元素是氧元素,Ca2Mg5Si8O22(OH)2属于盐类,故B错误;
C.玉石材料性质稳定,属于盐类易被强酸腐蚀,故C错误;
D.属于盐是硅酸钙、硅酸镁不溶于水,故D错误;
故选A.
点评 本题考查了硅酸盐的组成、性质等知识,注意知识的积累,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
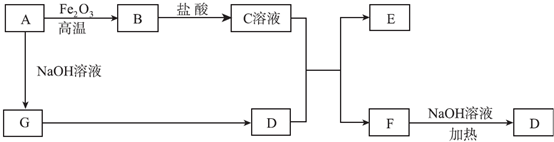
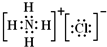 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Ba(OH)2溶液中滴加NaHSO4溶液至恰好为中性:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| B. | NH4HCO3溶液与过量KOH浓溶液共热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | 氢氧化钙溶液与碳酸氢镁溶液反应:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| D. | KI溶液与H2SO4酸化的H2O2溶液混合:2 I-+H2O2+2 H+═2 H2O+I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 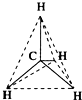 结构示意图 | B. |  电子式 | C. | 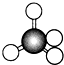 球棍模型 | D. |  比例模型 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等于2 | B. | 在3~4之间 | C. | 等于3 | D. | 在2~3之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
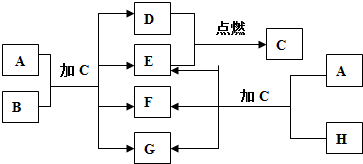
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com