
| A. | 混合液中由水电离出的c(H+)=1×10-8mol/L | |
| B. | c(A-)+c(HA)=2c(Na+)=0.4mol/L | |
| C. | HA溶液中$\frac{c({A}^{-})}{c(HA)•c(O{H}^{-})}$与混合液中$\frac{c({A}^{-})}{c(HA)•c(O{H}^{-})}$相等 | |
| D. | c(A-)-c(HA)=2c(OH-)-2c(H+) |
分析 A.混合溶液的pH=5,溶液显示酸性,溶液中氢氧根离子为水电离的;
B.根据物料守恒进行判断,注意注意等体积混合,溶液浓度减小;
C.温度相同,A-离子的水解常数不变,据此进行判断;
D.根据电荷守恒、物料守恒进行解答.
解答 解:A.测得混合溶液的pH=5,HA过量,溶液显示酸性,反应后的混合液中氢氧根离子是水电离的,所以水电离的氢离子浓度为:c(H+)=1×10-9mol/L,故A错误;
B.根据物料守恒可得:c(A-)+c(HA)=2c(Na+),由于两溶液等体积混合,所以浓度减小一半,正确关系为:c(A-)+c(HA)=2c(Na+)=0.2mol/L,故B错误;
C.A-水解平衡常数只是受温度影响,温度不变,则其水解常数不变,所以溶液中$\frac{c({A}^{-})}{c(HA)•c(O{H}^{-})}$与混合液中$\frac{c({A}^{-})}{c(HA)•c(O{H}^{-})}$相等等,故C正确;
D.根据物料守恒可知:c(A-)+c(HA)=2c(Na+),根据电荷守恒可得:c(A-)+c(OH-)=c(Na+)+c(H+),两个守恒结合可得:c(HA)-c(A-)=2c(OH-)-2c(H+),故D错误;
故选C.
点评 本题考查了酸碱混合后溶液酸碱性判断及溶液离子浓度大小比较,题目难度中等,注意掌握酸碱混合溶液酸碱性的判断方法,能够根据电荷守恒、物料守恒、盐的水解判断溶液中离子浓度大小.


 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
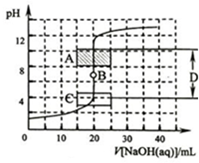 酸碱中和滴定是利用中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的试验方法.例如用一定浓度的氢氧化钠溶液滴定一定浓度的盐酸,其间溶液的pH变化是判断滴定终点的依据.
酸碱中和滴定是利用中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的试验方法.例如用一定浓度的氢氧化钠溶液滴定一定浓度的盐酸,其间溶液的pH变化是判断滴定终点的依据.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合前pH(CH3COOH)+pH(NaOH)=14 | B. | 混合后c(Na+)=c(CH3COO3-)+c(OH-) | ||
| C. | 混合前c(CH3COOH)>c(NaOH) | D. | 混合后c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
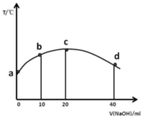 若往20ml 0.01mol/LCH3COOH溶液中逐滴加入一定浓度的烧碱溶液,测的溶液的温度变化如图所示,下列有关说法正确的是( )
若往20ml 0.01mol/LCH3COOH溶液中逐滴加入一定浓度的烧碱溶液,测的溶液的温度变化如图所示,下列有关说法正确的是( )| A. | c点时,醋酸的电离程度和电离常数都最大,溶液呈中性 | |
| B. | 若b点混合溶液显酸性,则2c(Na+)=c(CH3COO-)+c(CH3COOH) | |
| C. | 混合溶液中水的电离程度:b>c>d | |
| D. | 由图可知,该反应的中和热先增大后减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在Na2B、NaHB两溶液中,离子种类不相同 | |
| B. | 二元酸H2B为强酸 | |
| C. | 在NaHB溶液中一定有:c(Na+)+c(H+)=c(HB-)+c(OH-)+2c(B2-) | |
| D. | 在Na2B溶液中一定有:c(Na+)>c(B2-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| a气体 | b溶液 | 预测的现象 | |
| ① | C02 | BaCl2溶液 | 白色沉淀析出 |
| ② | SO2 | Ba(NO3)2 溶液 | 白色沉淀析出 |
| ③ | Br2 | AgNO3溶液 | 淡黄色沉淀析出 |
| ④ | NH3 | AlCl3溶液 | 白色沉淀析出 |
| A. | ①②③ | B. | ②③④ | C. | ①②④ | D. | ①③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com