
下表是部分短周期元素的原子半径及主要化合价,根据表中的信息,判断下面叙述正确的是
| 元素代号 | L | M | Q | R | T |
| 原子半径(nm) | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
A.L2+与R2-的核外电子数相等
B.M与T形成的化合物具有两性
C.单质与同浓度的稀盐酸反应的速率为Q>L
D.R与T的氢化物熔沸点高低为H2R>H2T
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
水溶液X中只可能溶有K+、Mg2+、Al3+、AlO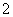 、SiO
、SiO 、CO
、CO 、SO
、SO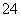 中的若干种离子。某同学对该溶液进行了如下实验:
中的若干种离子。某同学对该溶液进行了如下实验:
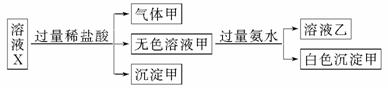
下列判断正确的是
A.气体甲一定是纯净物
B.沉淀甲是硅酸和硅酸镁的混合物
C.K+、AlO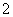 和SiO
和SiO 一定存在于溶液X中
一定存在于溶液X中
D.CO 和SO
和SO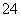 一定不存在于溶液X中
一定不存在于溶液X中
查看答案和解析>>
科目:高中化学 来源: 题型:
25℃时,0.1 mol/L的HA溶液中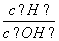 =1010,0.01 mol/L的BOH溶液pH=12。请回答下列问题:
=1010,0.01 mol/L的BOH溶液pH=12。请回答下列问题:
(1)HA是____________(填“强电解质”或“弱电解质”,下同),BOH是____________。
(2)HA的电离方程式是_______________________________________________。
(3)在加水稀释HA的过程中,随着水量的增加而减小的是________(填字母)。
A. B.
B.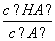
C.c(H +)与c(OH-)的乘积 D.c(OH-)
+)与c(OH-)的乘积 D.c(OH-)
(4)在体积相等、pH相等的HA溶液与盐酸溶液中加入 足量Zn,HA溶液中产生的气体比盐酸中产生的气体________(填“多”、“少”或“相等”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
若甲烷与氯气以物质的量之比1:3混合,在光照下得到的产物:①CH3Cl②CH2Cl2③CHCl3④CCl4,其中正确的是
A.只有① B.只有② C.①②③的混合物 D.①②③④的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
据报道,美国正在研究的锌电池可能取代目前广泛使用的铅蓄电池。锌电池具有容量大、污染少等优点。电池反应为2Zn+O2=2ZnO,原料为锌粒、电解液和空气。下列叙述正确的是
A.锌为正极,空气进入负极反应
B.负极反应为Zn+2OH--2e-=ZnO+H2O
C.正极发生氧化反应
D.电解液肯定是强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学反应属于区域3的是
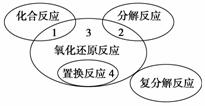
A.4Fe(OH)2+O2+2H2O===4Fe(OH)3
B.2NaHCO3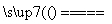 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
C.4NH3+5O2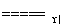 4NO+6H2O
4NO+6H2O
D.Zn+H2SO4===ZnSO4+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
某强酸性反应体系中,反应物和生成物共六种物质:PbO2、PbSO4(难溶盐)、Pb(MnO4)2(强电解质)、H2O、X(水溶液呈无色)、H2SO4,已知X是一种盐,且0.1 mol X在该反应中失去3.01×1023个电子。
(1)写出该反应的化学方程式:________________________________________________;
(2)若有9.8 g H2SO4参加反应,则转移电子的物质的量为________;
(3)本反应体系中,若用浓盐酸代替硫酸,用离子方程式表示后果:________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在1100℃,一定容积的密闭容器中发生反应:FeO(s)+CO(g) Fe(s)+CO2(g)
Fe(s)+CO2(g)
△H=a kJ/mol(a >0),该温度下K=0.263,下列有关该反应的说法正确的是 ( )
| A.若生成1 mol Fe,则吸收的热量小于a kJ B.若升高温度,正反应速率加快,逆反应速率减慢,则化学平衡正向移动 C.若容器内压强不随时间变化,则可以判断该反应已达到化学平衡状态 D.达到化学平衡状态时,若c(CO)=0.100 mol/L,则c(CO2)=0.0263 mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com